研究蛋白質晶體結構的物理化學分支學科。蛋白質分子是由上百或更多的α-胺基酸作為單體縮合而成的多肽(見肽)鏈構成的。能構成蛋白質中多肽鏈的α-胺基酸總共有 20種L-胺基酸。通過它們不同的組合和排列形成胺基酸順序不同的多肽鏈,然後這些多肽鏈進一步通過交聯構成千萬種蛋白質分子。
基本介紹
- 中文名:蛋白質晶體化學
- 學科:物理化學分支學科
- 構成:由α-胺基酸單體縮合而成多肽鏈
介紹
研究蛋白質晶體結構的物理化學分支學科。蛋白質分子是由上百或更多的α-胺基酸作為單體縮合而成的多肽(見肽)鏈構成的。能構成蛋白質中多肽鏈的α-胺基酸總共有 20種L-胺基酸。通過它們不同的組合和排列形成胺基酸順序不同的多肽鏈,然後這些多肽鏈進一步通過交聯構成千萬種蛋白質分子。
多肽鏈的胺基酸順序及其交聯的位置代表蛋白質分子的一級結構。
在一級結構的基礎上,蛋白質分子中的多肽鏈按一定的方式在空間分布,形成二級和三級立體結構等。
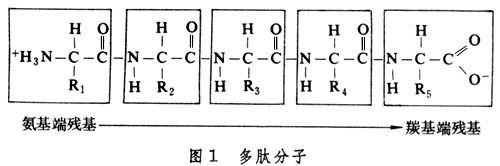
L-胺基酸、 多肽鏈和二硫橋蛋白質分子是一個由α-胺基酸單體相互縮合而成的多肽分子(圖1)。其中每個胺基酸縮合後殘留的部分稱為胺基酸殘基。
多肽分子中前一個殘基中羰基碳原子與後一個殘基中的氨基氮原子之間形成一個肽鏈。多肽分子以氨基端為頭,而以羧基端為尾。
組成蛋白質分子的α-胺基酸都是L-異構體,其絕對構型見圖2。
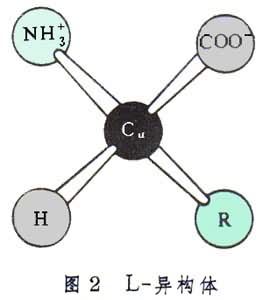
每個胺基酸或其殘基中羧酸根α位上的碳原子 Cα直接與氫原子、氨基和側鏈R基相連。在L-異構體中,從Cα向R 看 時,按順時針順序排列是H、NH幦和COO。存在於蛋白質分子中的20種胺基酸各以其側鏈R基而相區別。
胺基酸的名稱及其R基表示如下:
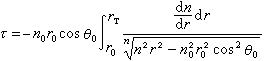
甘氨酸的R基為一個氫原子,而其他胺基酸的R基分別為脂肪側鏈、帶羥基的脂肪側鏈、帶芳香環的側鏈、鹼性側鏈、帶羧酸基的側鏈、帶醯胺基的側鏈和含硫側鏈等。脯氨酸的側鏈是一個丙二基(-CH2-CH2-CH2-),一端與Cα相連,另一端則與脯氨酸中氨基的氮原子相連,形成一個五元環,並使其中氨基成為一個仲氨基,而在其他胺基酸中都是伯氨基。這樣,脯氨酸縮合到多肽中後所得殘基在氮原子上已無氫原子,即
。
脯氨酸的這個特點對多肽鏈的立體結構很有影響。
多肽鏈鏈內或鏈間的兩個半胱氨酸可以通過氧化作用形成二硫橋。二硫橋使多肽鏈內不同部分或鏈間形成交聯:
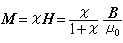
蛋白分子內各個多肽鏈中胺基酸的順序及其中二硫橋的位置稱為它的一級結構,圖3

示出1955年F.桑格測定出的牛胰島素分子的一級結構。牛胰島素分子由21肽的A鏈和30肽的B鏈,通過三個S-S橋形成。中國化學工作者已於1965年按這個一級結構合成出結晶胰島素。
蛋白質分子的結構層次蛋白中的多肽鏈往往不是一個如圖4
所示完全伸展的鏈。L.C.鮑林和R.B.科里曾由胺基酸、小肽和有關化合物晶體結構的測定中歸納了肽鍵的鍵長、鍵角等。鏈中肽鍵N-C的鍵長為1.32埃,具有40%的雙鍵成分,與周圍四個鍵是共面的,且N-H和C=O具有反式構型。肽鍵因具雙鍵成分而無旋轉的自由,但它周圍的每個Cα原子與相鄰兩個肽鍵中的氮和碳原子所形成的Cα-N和Cα-C單鍵都具有較大的迴旋餘地,從而一個多肽鍵可能存在於不計其數的構象或立體結構中,其中有些構象使未成鍵原子間形成較多較強的氫鍵並產生其他能使整個分子趨於穩定的相互作用。
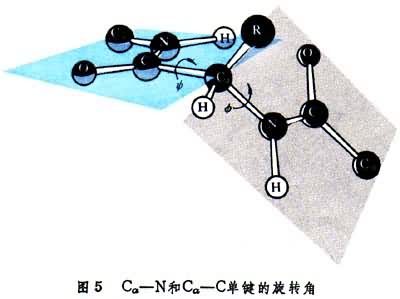
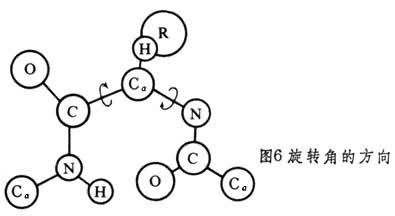
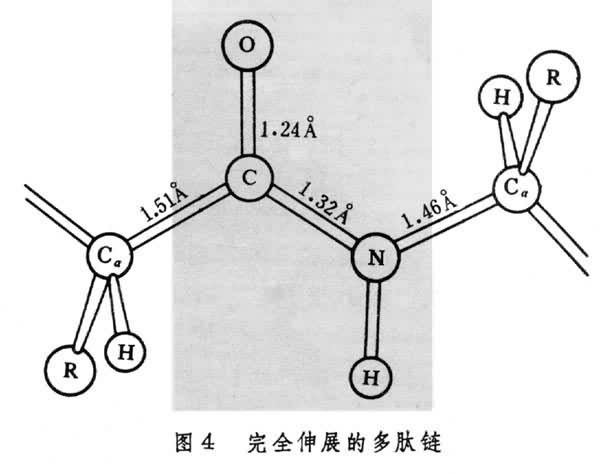
圖5中示出決定多肽鏈構象的每個Cα原子參與的Cα-N和Cα-C單鍵旋轉角φ和Ψ。φ和Ψ為180°時,給出完全伸展的構象,當φ和Ψ都為0°時,將使左方肽中的N-H與右方肽中的C=O互相接觸(圖6)。角φ和Ψ以Cα給出的順時針方向為正。多肽鏈中的N-H和C=O基團當參與形成較強的氫鍵時,氫鍵N-H…O長度約為2.80埃,而N→H與N→O之間的交角不超過30°。
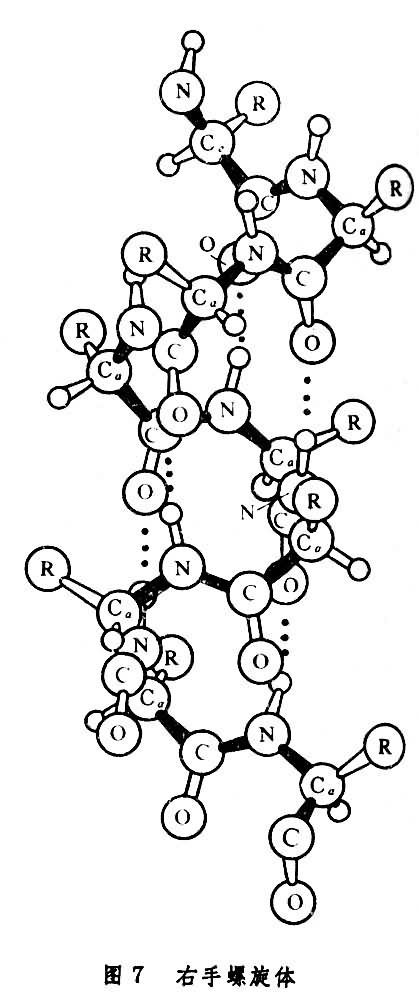
多肽鏈中諸殘基的Cα原子若具有相同的φ和Ψ角,則勢必形成一種周期結構,而有些φ和Ψ角可使這樣的結構中形成充分的氫鍵,以增強結構的穩定性,這樣的結構稱為多肽鏈的二級結構。鮑林和科里在1951年根據化學鍵理論和晶體結構數據,為多肽鏈推引出α-螺旋和β-摺疊片兩種二級結構。其中所有的N-H和C=O基團都相互形成了較強的氫鍵。α-螺旋體中與每個殘基的φ和Ψ 約為-60°和-40°。這樣得出的是一個如圖7所示的每轉含有3.6個殘基的右手螺旋體,其中第n個殘基的N-H與鏈內第(n-4)個殘基的C=O形成了較強的氫鍵。
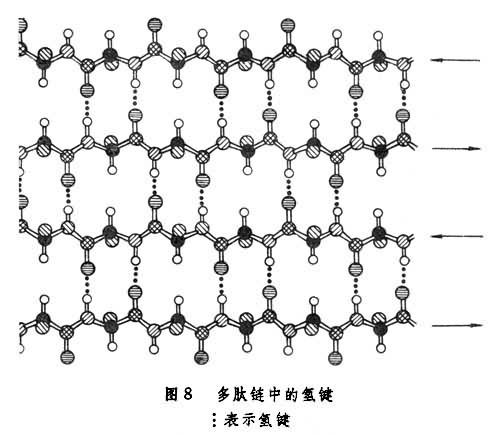
另一種重要的二級結構為β-摺疊片,其中每個殘基的φ和Ψ都接近180°,從而有近於伸展的多肽鏈。圖8所示的這種二級結構中鏈間或鏈段之間的N-H和C=O基團也都形成了較強的氫鍵。
這樣的二級結構以或大或小的含量,相當廣泛地存在於各種球蛋白和纖維蛋白中。在功能變化多端的球蛋白分子中,結構還有更高的層次。這兩類周期結構並不貫穿在整個多肽鏈中,而存在於某些分段中。這樣,多肽鏈摺疊成球形的三級結構,並進一步決定其特異的功能。在血紅蛋白中三級結構作為一個亞基,而若干亞基還可形成一個四級結構。前已提及,20種胺基酸的側鏈各不相同,其中有非極性的疏水基團,而極性側鏈還有鹼性和酸性之分。側鏈間以及與其他分子間,存在著相互作用,這不能不對基於主鏈上N-H和C匉O間氫鍵形成的二級結構周期性有所干擾。至於脯氨酸殘基在主鏈上因只有仲氨基,無從參與氫鍵的形成,勢必使α-螺旋這樣的二級結構難以為繼。
紅蛋白的高級結構及其載氧功能 肌紅蛋白和血紅蛋白晶體不難培養。在它們的衍射圖上,衍射點數以萬計。套用重原子同晶置換法,可以解決周相問題。它們的結構測定工作終於從1957年起開始突破。結構晶體學對我們理解蛋白的結構和功能作出了決定性的貢獻,迄今為止,它仍為完整地揭示蛋白三維結構的唯一途徑。
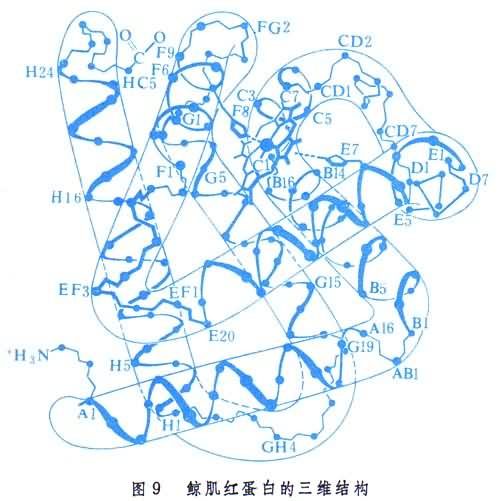
鯨肌紅蛋白含一個146肽。它的三維結構見圖9。從圖可見蛋白分子中的結構層次。肌紅蛋白中α-螺旋體含量高達75%。分子共有八段α-螺旋,其中有四段中斷於分子所含有的四個脯氨酸殘基。所得結果證實,肽鍵確實都具有共面和反式的構型。三級結構的整體內外明顯有別,內向的全是非極性或疏水殘基,而外向的都是極性殘基。
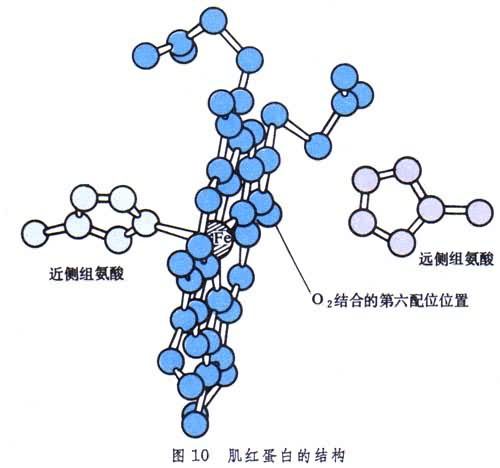
肌紅蛋白還含一個血紅素分子,處在多肽鏈盤成的一個溝中,起著活性部位的作用(圖10)。分子中央平面兩側各有一個組氨酸殘基,近側的一個占第五配位,而遠側的靠近留給氧分子的第六配位。
肌紅蛋白為什麼要一個 146肽來陪伴血紅素?這裡有兩個問題要澄清。首先,若沒有多肽鏈,則血紅素分子很容易互相接近,夾住一個氧分子,使自身中的Fe(Ⅱ)氧化成Fe(Ⅲ),從而在第六配位上只結合H2O而不能結合O2分子。其次,血紅素與一氧化碳的結合比與氧的結合要強25000倍,是因為一氧化碳不像氧那樣斜著與鐵成鍵。在肌紅蛋白中,由於多肽鏈提供的遠側組氨酸的作用,迫使一氧化碳也要斜著成鍵。這樣,它與血紅素的結合就只比氧強200倍了(圖11)。
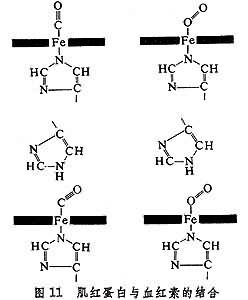
晶體中的肌紅蛋白結構會不會與溶液或活體中的很不一樣?將溶液、活體和晶體中肌紅蛋白的活性、吸收光譜、α-螺旋含量加以對比,即可打消這個顧慮。另外,海豹的肌紅蛋白和鯨的肌紅蛋白晶型很不一樣,但高級結構都很一致,從而說明這個具有活性的三級結構的唯一性。
血紅蛋白由四條多肽鏈組成,記號為α2β2。它們各與血紅素結合,形成四個亞基。四個亞基聚集在一起的方式稱為四級結構。亞基之間殘基的順序都有些差別,但高級結構很相似。