基本性質
自然界中發生的變化是自發進行的。例如鐵在潮濕的空氣中生鏽,冰在常溫下融化等。這種在一定條件下不需要外力作用就能進行的過程叫做自發過程。
1、自發過程均具有方向性。自發過程都只能向著與熱力系統外界趨於平衡的方向進行。非自發過程的進行都必須以補償過程的發生為條件。
2、自發過程均是不可逆過程。熱力系統經過一個自發過程後,若要使其反向進行恢復到初始狀態,則必須提供補償條件,這樣在外界必將留下不可逆的變化。
3、 各種不可逆過程具有等效性。各種不可逆因素不是彼此獨立無關的,而都是相互關聯的。一個不可逆過程發生後,會留下某種不可逆變化,要使它恢復到原來的初始狀態,就必然引起第二個不可逆過程的發生,勢必產生另一個不可逆變化,要使第二個不可逆過程恢復到原來的初始狀態,就不可避免的引起第三個不可逆過程的發生,依此類推下去,最後必然有一個不可逆變化遺留下來。因此一切不可逆過程都可以相互代替,這正說明了一切不可逆過程在本質上是一樣的,等效的。
舉例
1、在一個箱子裡,中間用隔板隔開,設法使兩邊的氣體壓力不等。將隔板去掉後,壓力大的一方氣體將自動地向壓力小的一方流動,直到兩邊的壓力相等。在這個過程中,人們可以用它做功,如做膨脹功,壓力相等後,要想使它恢復到原來的狀態,即一方壓力大,另一方壓力小,除非人們對它做功,如用壓縮機將氣體從一方壓縮到另一方去,否則是不可能自動復原的。
2、兩個溫度不同的物體接觸,熱就會自動地從高溫物體傳向低溫物體,直至溫度相等為止。人們可以利用溫度不等做功。溫度相等後,要想使兩物體的溫度再恢復到一高一低的原來狀態,必須對它做功,如用制冷機等,否則是不可能自動復原的。
3、將兩個電勢不同的電極組成電池,電流就從高電勢自動地流向低電勢,直至電勢相等。人們可以用電流做功,如照明、加熱等二電流不會自動地從低電勢流向高電勢,除非人們對它做功,如用發電機充電,
變化量
過程為恆溫恆壓時,能以
吉布斯自由能決定其自發性,其數學式如下:
ΔG=ΔH-TΔS
由上式可知,吉布斯自由能(G)變化量之正負取決於焓(H)、熵(S)之變化量以及絕對溫度(T)之大小。當絕對溫度之值等於焓變化量對熵變化量之比值時,吉布斯自由能之變化量為零。
當過程之吉布斯自由能變化量為:
負值,該正向過程為自發。
正值,該正向過程為非自發,但反向過程為自發。
零,該過程處於熱力學平衡,系統隨時間無淨變化。
藉由上式,討論焓變化量與熵變化量對吉布斯自由能變化量之影響,分為四種情況:
當熵變化量大於零,且焓變化量小於零,過程必然自發。
當熵變化量小於零,且焓變化量大於零,過程必然不自發,但逆過程必然自發。
當熵變化量大於零,且焓變化量大於零,過程於高溫狀態下自發、低溫狀態下不自發。
當熵變化量小於零,且焓變化量小於零,過程於低溫狀態下自發、高溫狀態下不自發。
於後兩個情況下,可由焓變化量對熵變化量之比值大小,決定該過程之溫度為高溫或低溫。
由熵決定
當利用熵變化量作為判斷過程自發性之函式時,需要特別留意系統與外界的定義。由熱力學第二定律,當
孤立系統之熵值隨時間而增加,則該過程為自發。然而,當考慮之系統為開放或封閉時,總熵(包含系統熵與外界熵)需隨時間增加。其數學式應表示為:
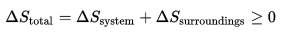 數學表達式
數學表達式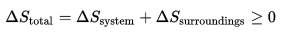 數學表達式
數學表達式