分類 (一) 單克隆抗體類免疫檢查點( immune checkpoint inhibitor )抑制劑
1. PD-1/PD-L1 通路與 PD-1/PD-L1 抑制劑
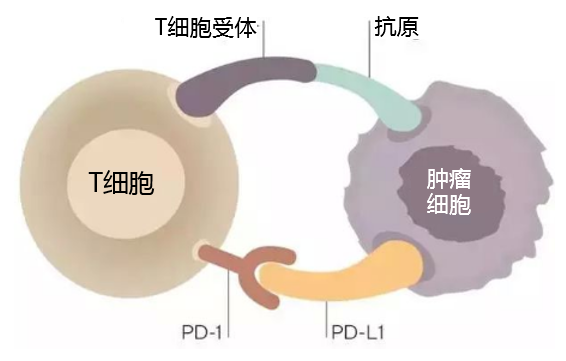
抗程式性死亡蛋白1(programmed death 1, PD-1)抗體是目前研究最多,臨床發展最快的一種免疫療法。PD-1起作用在免疫反應的效應階段,其表達於活化的T細胞,B細胞及髓系細胞,其有兩個配體,即程式性死亡分子配體-1(programmed death ligand 1, PD-L1)和PD-L2。PD-L1/L2在抗原提呈細胞都表達,PD-L1在多種組織也有表達。PD-1與PD-L1的結合介導T細胞活化的共抑制信號,抑制T細胞的殺傷功能,對人體免疫應答起到負調節作用。華裔科學家陳列平實驗室首先發現PD-L1在腫瘤組織高表達,而且調節腫瘤浸潤CD8+ T細胞的功能。因此,以PD-1/PD-L1為靶點的免疫調節對抗腫瘤有重要的意義。
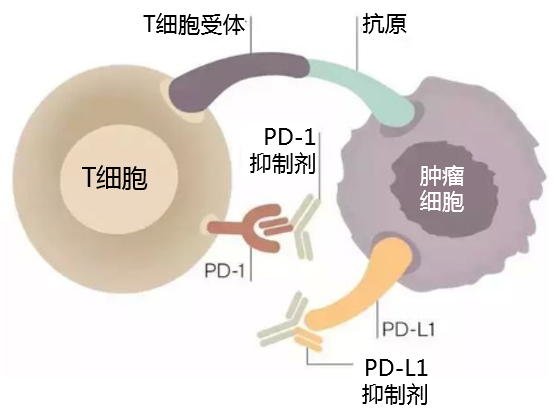
PD-1/PD-L1抑制劑能夠特異性地和腫瘤細胞上的PD-L1結合來抑制其表達,從而能夠使功能受抑制的T細胞恢復對腫瘤細胞的識別功能,從而實現通過自身免疫系統達到抗癌作用。
近年來,已有多種PD-1/PD-L1單克隆抗體在腫瘤免疫治療的臨床研究迅速開展。目前PD-1抑制劑Pembrolizumab和Nivolumab已被FDA批准用於晚期黑色素瘤、非小細胞肺癌、霍奇金淋巴瘤和頭頸鱗癌等,Nivolumab還被FDA批准可用於治療腎癌和尿路上皮癌等。此外,PD-L1抑制劑Atezolizumab和Durvalumab等單克隆抗體也已進入多個III期臨床研究中,覆蓋非小細胞肺癌、黑色素瘤、膀胱癌等多個瘤種。
2.CTLA-4 抑制劑
細胞毒性 T淋巴細胞抗原4(cytotoxic T-lymphocyte antigen 4, CTLA-4)是表達於活化的T細胞表面的一種跨膜蛋白。CTLA-4作用於免疫反應的啟動階段,其激活能夠抑制T細胞免疫應答的啟動,從而導致活化的T細胞減少並阻止記憶性T細胞的生成。研究發現,腫瘤細胞能夠激活CTLA-4,使活化的T細胞失去活性,從而實現了腫瘤自身的免疫逃逸(immune escape)。
數個臨床前研究發現,阻斷CTLA-4後能夠恢復T細胞的活性並延長記憶性T細胞的存活時間,從而恢復身體對腫瘤細胞的免疫功能,使得腫瘤的控制率提高,據此研發了抗CTLA-4 的特異性單克隆抗體。
目前兩種CTLA-4抑制劑Ipilimumab已被FDA批准用於III期黑色素瘤的輔助治療和晚期黑色素瘤的治療,而Ipilimumab和Tremelimumab在腎癌、前列腺癌、肺癌等的臨床研究已廣發開展。早期期臨床研究結果顯示兩種單抗無論是單藥還是聯合IL-2、PD-1/PD-L1抑制劑或化療均顯示安全有效。
3. 其它類型單克隆抗體
其它如增強T細胞第二信號從而促進腫瘤特異性T細胞活化和增殖的單抗類,如腫瘤壞死因子TNF受體家族的OX40和4-1BB單抗尚在研發中。
4. 免疫檢查點抑制劑常見不良反應及管理
由於免疫檢查點抑制劑治療是通過利用機體自身的免疫系統殺傷腫瘤,能夠解除免疫系統的抑制狀態,因此免疫檢查點抑制劑的相關不良事件包括幾乎所有的器官。如皮膚(斑丘疹、白癜風、銀屑病、萊爾綜合徵、藥物相關多器官遲發超敏反應)、胃腸道(小腸結腸炎、胃炎、胰腺炎、乳糜瀉)、內分泌器官(甲狀腺功能亢進或減低、垂體炎、腎上腺功能不全、糖尿病)、肺(免疫性肺炎、胸膜炎、肺肉瘤)、外周和中樞神經系統(外周神經病變、無菌性腦膜炎、格林巴利綜合症、腦神經病變、脊髓炎、腦膜腦炎、肌無力)、肝臟(免疫性肝炎)、腎臟(間質性腎炎、狼瘡性腎小球腎炎)血液系統(溶血性貧血、血小板減少症、粒細胞減少症、三系減少症)、肌肉關節系統(關節炎、肌肉病變)、心臟(心包炎、心肌炎)、眼睛(葡萄膜炎、結膜炎、視網膜炎、脈絡膜炎、眼瞼炎、眶周肌炎)等。所引發的毒性事件嚴重程度也不一樣,有的症狀較輕,易於管理,也有的症狀嚴重,能夠危及生命。免疫相關不良反應的整體發生率低於化療的不良反應,耐受性良好,治療出現的最常見不良反應為疲乏、食慾下降、噁心、無力和皮疹等,整體嚴重不良反應(3/4級不良反應)發生率7-13%,大部分不良反應均可逆且可管理。免疫治療過程中應做好免疫相關不良反應的預防、評估、檢查、治療和監測,及時發現治療相關不良反應,調整用藥劑量並使用皮質類固醇激素進行相應治療。
(1) 預防高危人群:個人或者家族的自身免疫疾病史;腫瘤瀰漫性浸潤,如癌性淋巴管炎,腫瘤浸潤合併周圍炎症;機會性感染,慢性感染等,已引起T細胞耗竭和凋亡;某些藥物如抗心律失常藥、降壓藥、抗生素、抗痙攣藥、或抗精神病藥等本身就與自身免疫疾病有關。
(2) 檢查:免疫毒性常伴有的症狀有皮膚症狀、胃腸道症狀、內分泌症狀。此外,還包括神經症狀、呼吸系統症狀、風濕症狀、肝病症狀、血液學症狀、腎病症狀、心血管症狀以及眼科症狀。免疫異常毒性在任何時間都有可能發生。根據發病時間中位數,免疫異常毒性可以分為早期(< 2個月)和晚期(> 2個月)毒性。早期毒性包括皮膚(5周)、胃腸(7.3周)、以及肝臟(7.7周),而晚期毒性包括肺部(8.9周)、內分泌(10.4周)以及腎臟(15.1周)。有的免疫異常毒性會延遲發生,有的甚至在接受免疫治療1年後才會發生。
(3) 治療:增強T細胞免疫反應帶來的副作用就是潛在的正常組織發生自身免疫性炎症。大多數情況下,使用免疫調節的藥物即可以控制這些副作用。對抗這些炎症反應,尤其是發展到嚴重階段時,最佳的藥物便是激素。對於激素治療不滿意的患者,其他免疫調節藥物也可以選擇,比如抗TNF-α抗體英利昔單抗、麥考酚酸酯、他利莫司、環孢素等。T細胞耗竭藥物如抗人胸腺細胞球蛋白也在罕見案例中報導有效。
若發生相關免疫檢查點抑制劑相關的不良反應,請及時與醫護人員聯繫。
(二) 治療性抗體
治療性抗體是實驗室合成設計的能夠摧毀腫瘤細胞的抗體,試圖通過不同途徑來殺傷腫瘤細胞,包括抗體依賴細胞介導的細胞毒作用(antibody-dependent cell-mediated cytotoxity, ADCC)、補體依賴的細胞毒作用(complement-dependent cytotoxity, CDC)和抗體直接誘導細胞凋亡。。目前多個治療性抗體已經獲批用於腫瘤臨床治療。1997 年第一個抗CD20的嵌合抗體——利妥昔單抗(Rituximab,美羅華)被美國FDA 批准上市,用於治療非霍奇金淋巴瘤。1998 年第一個人源化抗Her2 單抗——曲妥珠單抗(Trastuzumab,赫賽汀)上市,用於治療乳腺癌。2006年第一個抗表皮生長因子的人源抗體——帕尼莫單抗(Panitumumab)被批准治療結直腸癌。以及2011 年FDA 批准了新一代抗體藥物偶聯物(antibody-drug conjugates, ADCs)藥物——Adcetris,它由抗CD30嵌合抗體布妥昔單抗(Brentuximab)與單甲基金抑素奧利斯他汀E(Auristain E),治療淋巴瘤。
(三) 癌症疫苗
癌症疫苗是指將腫瘤抗原以多種形式,如腫瘤細胞、腫瘤相關蛋白或多肽、表達腫瘤抗原的基因等,導入患者體內,克服腫瘤引起的免疫抑制狀態,激活患者自身的免疫系統,從而達到控制或清除腫瘤的目的的治療方法。癌症疫苗可分為預防性疫苗和治療性疫苗。預防性疫苗,如宮頸癌疫苗,能夠有效預防某些致癌型HPV相關的宮頸疾病。首個腫瘤治療性疫苗——Sipuleucel-T疫苗(Provenge)於2010年4月29日被美國FDA批准用於治療前列腺癌。
(四) 細胞治療
在沒有外界干預的情況下,人體內可以識別腫瘤細胞的T細胞數目非常少,占比不足十萬分之一。細胞治療又稱為細胞過繼免疫治療(adoptive T cell transfer, ACT),是試圖通過外界修飾,讓普通T細胞成為能夠識別腫瘤細胞的T細胞,從而引發對腫瘤細胞的免疫作用。
過繼性細胞免疫治療根據其發展歷程依次為自體淋巴因子激活的殺傷細胞(lymphokine-activated Killer,LAK)、自體腫瘤浸潤性淋巴細胞(tumor infil-trating lymphocytes, TIL)、自然殺傷細胞(natural killer cell, NK)、細胞因子誘導的殺傷細胞(cytokine-induced killer, CIK)、細胞毒性T細胞(cytotoxicT lymphocyte, CTL)以及經基因修飾改造的T細胞(CAR-T、TCR-T)。
(1) 腫瘤浸潤性淋巴細胞(TIL)是從腫瘤部位分離出的淋巴細胞,在體外經IL-2等細胞因子擴增後產生,其表型以CD4T細胞和CD8T細胞為主,具有一定的腫瘤特異性和MHC限制性.儘管TIL治療黑色素瘤表現出了強大的細胞增殖能力和殺傷作用,但在其他腫瘤中並未出現類似療效。
(2) NK細胞免疫治療相關抗體已經用於黑色素瘤、肺癌和腎癌的治療。NK細胞屬於先天免疫系統,與T細胞不同,在發揮抗腫瘤效應前,不需要腫瘤特異性識別或者克隆擴增。NK細胞抗腫瘤效益,受細胞表面上大量受體的控制。
(3) CIK細胞是外周血單個核細胞經抗CD3單克隆抗體,以及IL-2、IFN-y、和IL-1α等細胞因子體外誘導分化獲得的NK樣T細胞,呈CD3、CD56表型,既具有非MHC限制性特點,又有T淋巴細胞抗腫瘤活。
(4) CTL細胞是機體特異性抗腫瘤免疫的主要效應細胞,其製備過程為:分離腫瘤細胞;調變腫瘤細胞:用直接導入方法或逆轉錄酶介導的轉移方法向腫瘤細胞導入B7基因,並檢測腫瘤細胞表達B7分子情況;誘導CTL:用調變修飾後的腫瘤細胞與效應細胞共培養,誘導高活性的CTL;分離CTL細胞用於臨床治療。
(5)最新的CAR-T治療方法:免疫學家從患者自身血液收集T細胞,收集之後對T細胞進行基因工程處理,從而在其表面表達能夠識別特異性腫瘤抗原的特殊受體,這種受體被稱為嵌合抗原受體(chimeric antigen receptor, CAR),同時在受體的胞內段加上引起T細胞活化的信號傳遞區域。CAR是一種蛋白質受體,可使T細胞識別腫瘤細胞表面的特定蛋白質(抗原),表達CAR的T細胞可識別並結合腫瘤抗原,進而攻擊腫瘤細胞。這種表達CAR的T細胞被稱為CAR-T。經過設計的CAR-T細胞可在實驗室培養生長,達到數十億之多將擴增後的CAR-T細胞注入到患者體內,注入之後的T細胞也會在患者體內增殖,並殺死具有相應特異性抗原的腫瘤細胞。CAR-T細胞治療已在臨床試驗中顯示出良好的靶向性、殺傷性和持久性,為免疫細胞治療提供了新的解決方案,展示了巨大的發展潛力和套用前景。目前已經在美國FDA獲批的CAR-T細胞藥物有Kymriah(Tisagenlecleucel, CTL-019),用於治療兒童和年輕成人(2~25歲)的急性淋巴細胞白血病(ALL)。以及Yescarta(AxicabtageneCiloleucel,KTE-C10),用於治療其他療法無效或既往至少接受過2種方案治療後復發的特定類型的成人大B細胞淋巴瘤患者。到目前為止這種方法僅限於小規模臨床試驗,這些經過設計的免疫細胞治療晚期血液腫瘤患者已產生一些顯著療效,並且正在嘗試用於實體瘤。雖然這些初步結果令人鼓舞,但是CAR-T細胞療法還有許多方面有待研究,如獨特的副作用,細胞因子釋放綜合症等。
(6)而TCR-T細胞療法同CAR-T療法一樣,也是通過基因改造的手段提高T細胞受體對特異性癌症細胞抗原的識別能力和進攻能力,TCR-T的原理是將患者的腫瘤浸潤性淋巴細胞(tumor-infiltrating lymphocytes, TILs)中,可通過限制性抗原識別殺傷腫瘤的T細胞提取,利用基因克隆技術獲取其T細胞受體(T cell receptor, TCR)序列,再利用載體將該段基因轉染至更多的T細胞上,使識別該抗原的T 細胞上萬倍的增長。TCR-T來自於TCR,因此可識別來源於細胞核、胞漿、胞膜的各種抗原。目前多個相關研究正在開展,部分研究結果前景較好。
(五) 小分子抑制劑
腫瘤微環境中有許多免疫抑制分子存在,通過調節這些抑制分子的功能進而改善腫瘤免疫微環境的免疫治療策略也受到了重視。吲哚胺-(2,3)-雙加氧酶(Indoleamine 2,3-dioxygenase, IDO),在腫瘤中表達的IDO介導了腫瘤的免疫逃逸。抗原提呈細胞如巨噬細胞、樹突狀細胞上的IDO均可通過抑制T細胞增殖來誘導T細胞對腫瘤抗原的免疫耐受。因此,IDO抑制劑能調節腫瘤微環境的色氨酸含量,避免腫瘤微環境中T細胞增殖受抑制,成為潛在的免疫治療靶點。多項I/II期臨床研究證實IDO抑制劑能夠提高PD-1/PD-L1抑制劑的療效。
(六) 免疫系統調節劑
免疫系統調節劑(Immune system modulators)是最早用於腫瘤免疫治療的一種手段,通常被稱為主動非特異性免疫治療(active nonspecific immunotherapy),最早可追索至William Coley在1892年使用鏈球菌培養物來治療肉瘤。免疫系統調節劑包括隨後發展的細胞因子治療(IL-2、INF)、合成的分子、免疫佐劑(卡介苗)及短肽(胸腺法新)。最近有學者套用瘧疾來治療腫瘤,其實也是利用了瘧原蟲激活的炎症反應、非特異性免疫作用。然而,免疫系統調節劑單藥的有效率只有10%,主要用於部分實體瘤,包括轉移性腎癌、惡性黑色素瘤。將來,聯合非特異性和特異性免疫治療,或將不同的免疫系統調節劑聯合使用是值得探索的方向。
腫瘤生物標記物 1. 腫瘤生物標記物的定義
目前,如何定義腫瘤生物標記物尚存在爭議,美國國家癌症研究所(NCI)將生物標記物定義為“在血液、其他體液或組織中發現的生物分子,該分子能夠作為異常過程或疾病的徵兆,生物標記物還可以用於判斷機體對於治療的應答。生物標記物或被稱為分子標誌物或分子標記”。我們可以認為,腫瘤生物標記物是能夠作為腫瘤徵兆或判斷腫瘤治療應答的生物分子,也就是說我們可以使用腫瘤生物標記物實現幫助診斷腫瘤、確定治療方案的選擇並預測治療療效。
2. 腫瘤生物標記物的作用
腫瘤生物標記物的作用貫串整個腫瘤診療過程,從腫瘤風險預測、診斷到治療方案選擇和療效預測都離不開它。更重要的是,腫瘤生物標記物的發現和套用,使得靶向治療和免疫治療成為可能並有效改善療效。
(1) 腫瘤風險預測
目前已經發現一些可用於預測腫瘤高危的生物標記物,例如BRCA1/2基因突變陽性的患者乳腺癌和卵巢癌的發病風險更高。
(2) 腫瘤診斷
雖然腫瘤診斷的金標準仍然是病理檢查,腫瘤生物標記物輔助診斷由於其便捷性和無創性也已經逐步普及開來。
(3) 預後和治療預測
隨著靶向治療和免疫治療方法的逐漸成熟,腫瘤生物標記物在治療和預後預測中展現出了相當的潛力,例如對於某些癌種而言PD-L1的表達越高,療效越好,但對某些腫瘤,PD-L1的表達不能夠預測療效,仍需探索更好的生物標記物。儘管如此,目前已有的臨床證據足以證明生物標記物在療效預測方面的潛力,在治療前進行相關生物標記物的檢測,有助於更好的實現精準治療從而選擇最為適合的治療方案。
(4) 預測或監視腫瘤復發
生物標記物也可用於預測或監視腫瘤復發,目前在乳腺癌領域已經有較成熟的套用,可用於預測乳腺癌10年內的復發風險。
3. 免疫治療中常見的腫瘤生物標記物
免疫治療中常見或潛在的生物標記物主要與以下幾個機制有關:1)腫瘤抗原,能夠提示高頻突變和新抗原的生物標記物,例如腫瘤突變負荷(TMB)、高度微衛星不穩定(MSI-H)等;2)炎性腫瘤微環境,能夠提示炎性表型的生物標記物,例如PD-L1、炎性特徵等;3)腫瘤免疫抑制,即除PD-1/CTLA-4以外能夠明確腫瘤免疫逃逸的生物標記物,例如Tregs、MDSCs、IDO、LAG-3等;4)宿主環境;5)腸道微生物,能夠提示宿主環境特徵的生物標記物。
(1) PD-L1
程式性死亡分子配體-1(PD-L1)是一種細胞表面蛋白,通過與活化的T、B細胞表面的PD-1受體相互作用,使T細胞失活,不再攻擊腫瘤細胞。臨床試驗發現PD-L1的高腫瘤表達與腫瘤侵襲性增加相關,並且死亡風險增加4.5倍;在肺非鱗癌患者中,PD-L1高表達的患者使用PD-1/PD-L1抑制劑的療效更優。
(2) 腫瘤突變負荷(TMB)
腫瘤突變負荷(tumor mutation burden,TMB)指的是一份腫瘤標本中,所評估基因的外顯子編碼區每兆鹼基中發生置換和插入/缺失突變的總數。高TMB腫瘤細胞可能具有更多的新抗原,從而導致腫瘤微環境和外周的抗腫瘤T細胞相應增多,因而可推測高TMB患者對腫瘤免疫治療產生反應的可能性更高。但值得注意的是,不同的癌種TMB表達水平不盡相同,某些腫瘤患者的總體TMB水平會更高。
(3) 錯配修復(MMR)
錯配修復(mismatch repair,MMR)指的是由糾正DNA複製期間所產生DNA錯配的酶組成,預防分裂細胞中的突變成為永久性突變,這一過程涉及4個關鍵基因MLH1、MSH2、MLH6和PMS2。而在錯配修復的過程中,部分情況下可能會出現某一個MMR蛋白缺失,從而導致未能成功檢測錯誤的情況,這種情況便被稱為錯配修復功能缺失(dMMR)。有時候MMR的異常會引發一系列癌變表型,臨床研究發現,MMR基因的突變或可幫助準確預測病人PD-1抑制劑的應答。
(4) 微衛星不穩定性(MSI)
微衛星是在人的基因組中發現的一種串聯重複DNA序列,如ATATATAT、CTCTCTCT、GGGG或AAAA。微衛星不穩定是基因組高頻突變所致的分子表型,是由錯配修復系統受損後無法修復微衛星區域的突變產生的。高度微衛星不穩定(MSI-H)就是指腫瘤的5個微衛星標記物中至少有2個標記物不穩定;僅1個標記物不穩定被歸類為低度微衛星不穩定(MSI-L);沒有不穩定標記物則為微衛星穩定(MSS)。臨床試驗發現,MSI-H的患者對免疫治療的應答更優。
(5)腸道微生物群(microbiome)
最近,腸道微生物群與免疫治療的關係受到密切關注。一項研究表明,腸道菌群可以調節抗黑色素瘤免疫治療的反應。“有利”的腸道微生物組(如高多樣性和富含Ruminococcaceae/Faecalibacterium)會增強抗原呈遞,改善T細胞功能和腫瘤微環境來增強抗腫瘤免疫反應。而“不利”的腸道菌群(如低多樣性和富含Bacteroidales)會破壞抗腫瘤反應。提示在接受免疫檢查點抑制劑治療時,應進行腸道菌群評估。也有研究提示,抗生素的套用因為對腸道微生物的影響,可能會消弱免疫治療的效果,但結論還需要進一步的證據來支持。