維里狀態方程是海克·卡末林·昂內斯(Heike Kamerlingh Onnes)於1901年提出的以冪級數形式表達的真實氣體狀態的方程,它是對理想氣體狀態方程式進行了修正的純經驗方程。
基本介紹
- 中文名:維里狀態方程
- 外文名:Virial equation of state
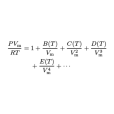
- 表達式:pVm = RT(1 + B/Vm + C/Vm^2 + D/Vm^3 + )
- 提出者:海克·卡末林·昂內斯
- 提出時間:1901年
- 適用領域:真實氣體
- 套用學科:熱力學
定律定義


推導過程

維里狀態方程是海克·卡末林·昂內斯(Heike Kamerlingh Onnes)於1901年提出的以冪級數形式表達的真實氣體狀態的方程,它是對理想氣體狀態方程式進行了修正的純經驗方程。



維里一詞來源於拉丁文virial,即力。維里方程是海克·卡末林·昂內斯(Heike Kamerlingh Onnes)於1901年提出的以冪級數形式表達的實際氣體狀態方程,它是對理想氣體狀態方程式進行了修正的純經驗方程。定律定義 維里方程的一般表達式:維...
狀態方程的研究可用理論方法和半經驗方法,各自得到相應的狀態方程。理論方程 從分子微觀運動出發,運用統計力學方法導出的狀態方程。例如著名的維里方程(維里一詞來自拉丁文,其意義是力):就是根據分子間相互作用力的概念,由統計力學...
維里係數(Virial coefficient)是熱力學狀態方程按密度展開(稱為維里展開)各項的係數。維里係數與分子間勢能函式相關,體現多體相互作用對理想氣體狀態方程的修正。例如,作為維里展開中密度平方相係數的第二維里係數只取決於粒子對間的...
第5章 流體狀態方程 5.1 立方型狀態方程 5.1.1 普遍化vanderWaals配分函式 5.1.2 純流體狀態方程 5.1.3 立方型方程的混合規則 5.2 對應狀態原理 5.2.1 巨觀對應態 5.2.2 對應態的分子理論 5.3 維里狀態方程 5.3.1...
2.2.3 Peng - Robinson狀態方程(PR方程)2.2.4 Patel-Teja方程(PT方程)2.3 對vdW立方型狀態方程的近代改進 2.3.1 對a(T)的修正 2.3.2 對p(v)函式形式的修正 2.4 維里狀態方程 2.4.1 方程的形式 2.4.2 維...
在計量氣體流量時由於要求計算準確度較高,通常需要考慮壓縮係數。隨著對氣體狀態方程準確度要求提高,在百餘年來實際氣體狀態方程出現了許多不同形式,對壓縮係數也有不同的表述。比較有名的是范德瓦爾狀態方程和維里狀態方程。
1-3 真實氣體自由能方程推導 二、分子聚集理論 2-1 分子聚集(締合)的狀態方程(聚集硬球分子模型)2-2 分子聚集型維里狀態方程(聚集硬球分子模型)2-3 分子的“雙阱模型”位能函式及其在第二維里係數計算中之套用 2-4 加壓條件下...
范德瓦耳斯方程仍只是一個近似的實際氣體狀態方程。其中常數a、b可以套用臨界參數P、V、T予以確定,即 ,,,或 ,。維里狀態方程 維里狀態方程形式為 ,或 ,式中A₀、A₁、A₂、…和B₀、B₁、B₂、…稱為維里係數...
