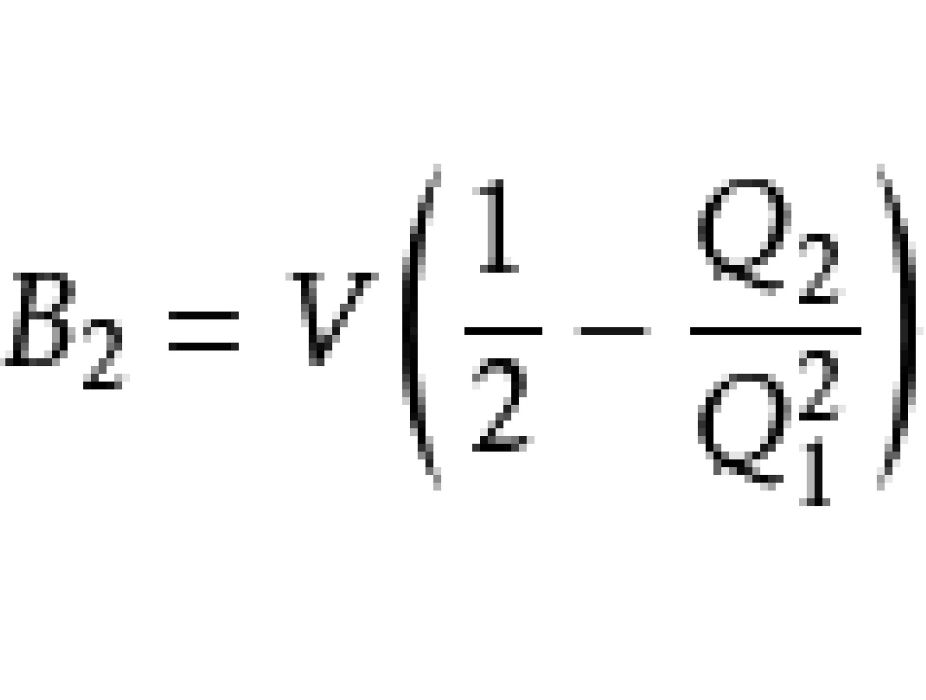維里係數(Virial coefficient)是熱力學狀態方程按密度展開(稱為維里展開)各項的係數。維里係數與分子間勢能函式相關,體現多體相互作用對理想氣體狀態方程的修正。包括第一、第二、第三維里係數等,第二維里係數是聯繫氣體的巨觀熱力學性質與微觀分子力學參量的一條有效途徑。它不僅在實用上可表示真實氣體的狀態,而且在理論上還可以驗證和發展分子作用勢模型,確定分子力學參量,從而預測物質的其它巨觀性質。
基本介紹
- 中文名:第二維里係數
- 外文名:Second virial coefficient
- 提出者:R.玻意耳、E.馬略特
- 套用學科:統計物理學
釋義,維里係數的由來,推導過程,
釋義
維里係數(Virial coefficient)是熱力學狀態方程按密度展開(稱為維里展開)各項的係數。維里係數與分子間勢能函式相關,體現多體相互作用對理想氣體狀態方程的修正。例如,作為維里展開中密度平方相係數的第二維里係數只取決於粒子對間的相互作用,而第三維里係數則取決於二體與三體間非加和性的相互作用。實驗上維里係數可從得到的狀態方程多項式擬合得到,理論上也可根據勢函式出發積分導出,唯高階解析式非常複雜,計算量迅速增大。維里係數是溫度的函式。
第二維里係數是聯繫氣體的巨觀熱力學性質與微觀分子力學參量的一條有效途徑。它不僅在實用上可表示真實氣體的狀態,而且在理論上還可以驗證和發展分子作用勢模型,確定分子力學參量,從而預測物質的其它巨觀性質。
維里係數的由來
許多實驗表明,氣體的性質都在不同程度上偏離玻意耳-馬略特定律,壓強越低,這種偏離越小,只有當壓強趨近於零的極限情形下,玻意耳-馬略特定律才是完全正確的。這種氣體稱為理想氣體。一般情況下,實際氣體的性質接近理想氣體,而在壓強趨於零時完全變為理想氣體。
為了描述實際氣體,H.開默林-昂內斯於1901年把一摩爾的實際氣體狀態方程表示成
pV=A+Bp+Cp2+Dp3+……或pV=A+B'/V+C'/V2+D'/V3+……
上述A、B、C、D、…或A、B'、C'、D'、…就分別稱為第一、第二、第三、第四、……維里係數,它們都是溫度的函式。當壓強趨於零(或體積趨於無窮大)時,A=RT(R是摩爾氣體常數),於是上面兩式就變成玻意耳-馬略特定律。各個維里係數都可由實驗測定。實驗表明,維里係數A、B、C、D、…或A、B'、C'、D'、…依次減小得很快,在實際套用上只需前兩、三項就夠了。
統計物理學認為,實際氣體對理想氣體的偏離是由於粒子之間的相互作用引起的。套用統計方法可以研究非理想氣體的性質。先把巨配分函式的對數展成級數,再根據它同壓強、溫度和體積的關係即可求得級數形式的實際氣體物態方程。這種方法適合於溫度不太低或密度不太高的系統,也就是說適用於對理想氣體稍有偏離的氣體系統,並只考慮粒子間的二體相互作用。由此可以得到壓強p按比容的倒數1/v的維里展開這就是實際氣體的狀態方程式,是壓強按粒子數密度(即1/υ)的冪級數展開式。
統計物理學認為,實際氣體對理想氣體的偏離是由於粒子之間的相互作用引起的。套用統計方法可以研究非理想氣體的性質。先把巨配分函式的對數展成級數,再根據它同壓強、溫度和體積的關係即可求得級數形式的實際氣體物態方程。這種方法適合於溫度不太低或密度不太高的系統,也就是說適用於對理想氣體稍有偏離的氣體系統,並只考慮粒子間的二體相互作用。由此可以得到壓強p按比容的倒數1/v的維里展開這就是實際氣體的狀態方程式,是壓強按粒子數密度(即1/υ)的冪級數展開式。
推導過程
得到維里係數解析式的第一步是根據巨正則系綜配分函式的簇展開(Cluster expansion):
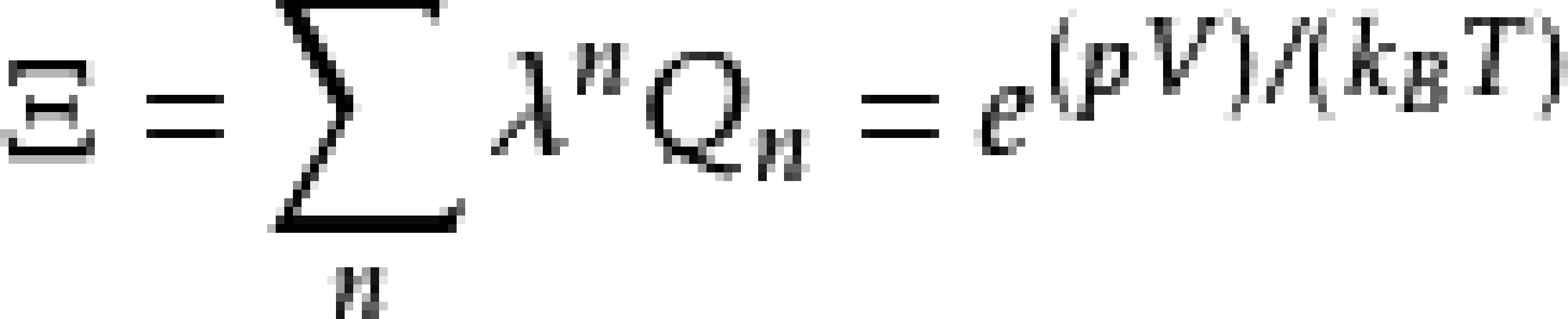
其中,p是壓強,V是系統體積,kB是波茲曼常數,T是絕對溫度,λ是逸度,μ是化學勢。Qn為包含n個粒子的子系統的配分函式。
Ξ的簇展開表示巨正則配分函式能展開為單體(理想氣體)、兩體、多體(簇)相互作用的貢獻之和。
與維里展開:
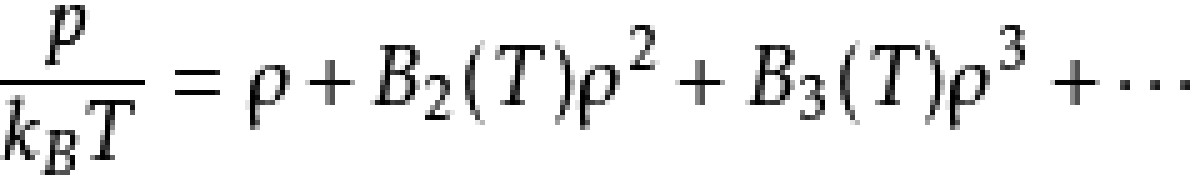
相比較,可得:
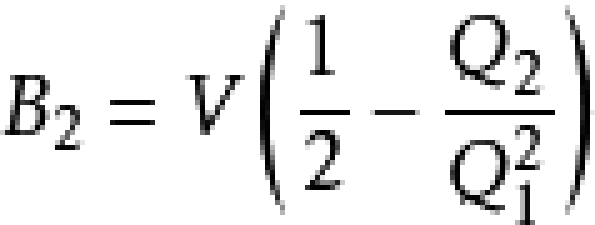
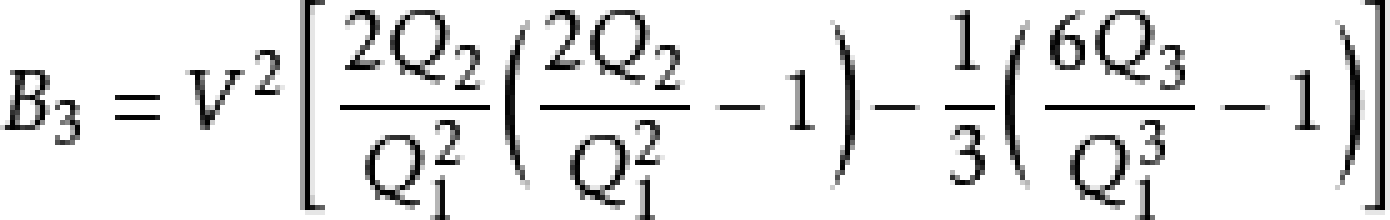
等等。此為內含動能項的量子統計表達式。注意到Q1僅僅包括動能項;熱力學極限下h=0,動能算符和勢能算符可對易,分子與分母的動能項互相消去。求解矩陣的跡成為對構型空間的積分,結果是經典的維里係數只由粒子間相互作用決定,而相互作用只由粒子坐標決定。因此可通過對構型空間積分求算維里係數。然而,比B3更高階的維里係數的遞推式變得非常複雜。約瑟夫·愛德華·邁耶和瑪麗亞·格佩特-梅耶提出了圖形表記積分式的方法演算維里係數。
他們引入了被稱為邁耶函式的表達式:
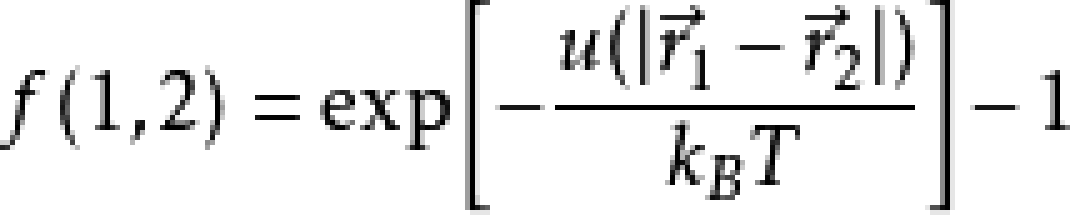
物理上表示玻爾茲曼因子與理想氣體的偏差。並將簇展開整理成邁耶函式的組合。