基本介紹
- 中文名:結構異構
- 外文名:structural isomerism
- 別名:構造異構
- 實質:化合物的同分異構現象
- 類別:鏈異構、位置異構和官能團異構
鏈異構
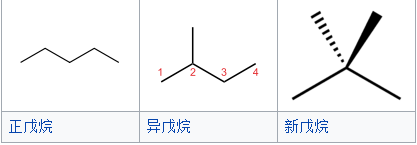 鏈異構舉例
鏈異構舉例位置異構
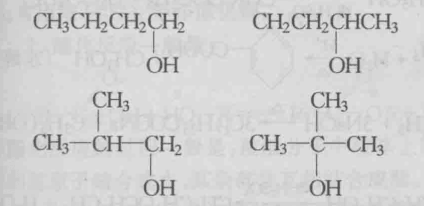 位置異構
位置異構官能團異構
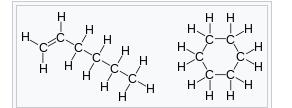 官能團異構
官能團異構相關擴展
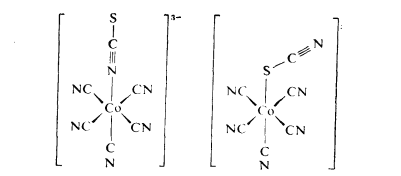 鍵合異構
鍵合異構 鏈異構舉例
鏈異構舉例 位置異構
位置異構 官能團異構
官能團異構 鍵合異構
鍵合異構構造異構是有機化學中同分異構體的一個重要類別,因分子中原子的連線次序不同或者鍵合性質不同引起的異構現象。它包括碳鏈異構、位置異構、官能團異構、互變異構和...
結構異構,也稱構造異構,是指由於化合物具有不同的原子連線順序而產生的同分異構現象,與立體異構相對。存在結構異構的化合物互稱結構異構體,它們又可分為鏈異構、...
分子式相同、結構不同的化合物稱為結構異構體,又稱為同分異構體。包括構造異構體與立體異構體。...
化學上,同分異構現象是指具有相同化學式,有同樣的化學鍵而有不同的原子排列的化合物。簡單地說,化合物具有相同分子式,但具有不同結構的現象,叫做同分異構現象;...
在有機化學中,異構體指的是化學組成相同而結構和性質不同的化合物,這種現象也稱為異構現象。異構現象通常分為兩大類:結構異構和立體異構。在聚合物的異構現象,...
異構(heterogeneous,來自中世紀拉丁文 heterogeneus,來自希臘語 heterogenēs ),即由不同的元素或部分組成,不均勻的意思。...
順反異構(Cis-trans isomerism)也稱幾何異構(geometric isomerism),屬於立體異構中的一種。順反異構是指化合物分子中由於具有限制自由旋轉的因素,使各個基團在空間...
異構資料庫系統是相關的多個資料庫系統的集合,可以實現數據的共享和透明訪問,每個資料庫系統在加入異構資料庫系統之前本身就已經存在。異構資料庫的各個組成部分具有...
異構計算技術從80年代中期產生,由於它能經濟有效地獲取高性能計算能力、可擴展性好、計算資源利用率高、發展潛力巨大,目前已成為並行/分布計算領域中的研究熱點之一...
異構網路(Heterogeneous Network)是一種類型的網路,其是由不同製造商生產的計算機,網路設備和系統組成的,大部分情況下運行在不同的協定上支持不同的功能或套用。...
定義:化學上,同分異構體是一種有相同分子式而有不同的原子排列的化合物。簡單地說,化合物具有相同分子式,但具有不同結構的現象,叫做同分異構現象;具有相同分子...
對映異構體都有旋光性,其中一個是上旋的,一個是下旋的。 所以對映異構體又稱為旋光異構體. 簡單的說也就是兩個異構體之間的關係就如同一個物體的立體結構在...
異構化,是指改變化合物的結構而分子量不變的過程。一般指有機化合物分子中原子或基團的位置的改變而其組成和分子量不發生變化。常在催化劑的存在下進行。化合物...
因此,構建一個完善的無線異構網路的安全體系,一般應遵循下列3個基本原則:(1)無線異構網路協定結構符合開放系統互聯(OSI)協定體系,因而其安全問題應從每個層次入手,...
異構資料庫系統是相關的多個資料庫系統的集合,可以實現數據的共享和透明訪問,向個資料庫系統在加人異構資料庫系統之前本身就已經存在,擁有自己的數據陣管理系統、外...
拓撲異構體是除鏈環數(linking number)不同外其他性質均相同的DNA分子,可以通過凝膠電泳檢測來觀察。...
異構烴的來源之一是生物合成,與正構烷烴共生。這些異構烴的主要特點是甲基取代基在2和3位上,即2甲基烷烴和3一甲基烷烴。在高等植物的蠟、海生植物和細菌的類脂...
