簡介
糖類抗原CA125 (Carbohydrate antigen 125) 是一種來自於體腔上皮細胞並可表達於正常組織的
糖蛋白。CA125通常作為卵巢上皮癌的腫瘤標誌物。其升高還可見於一些非婦科疾病。
發現歷史
最初使用命名為OC125的鼠單克隆抗體檢測CA-125。Robert Bast,Robert Knapp及其研究小組於1981年首次分離出這種單克隆抗體。該蛋白質被命名為“癌抗原125”,因為OC125是針對正在研究的卵巢癌細胞系產生的第125種抗體。
結構
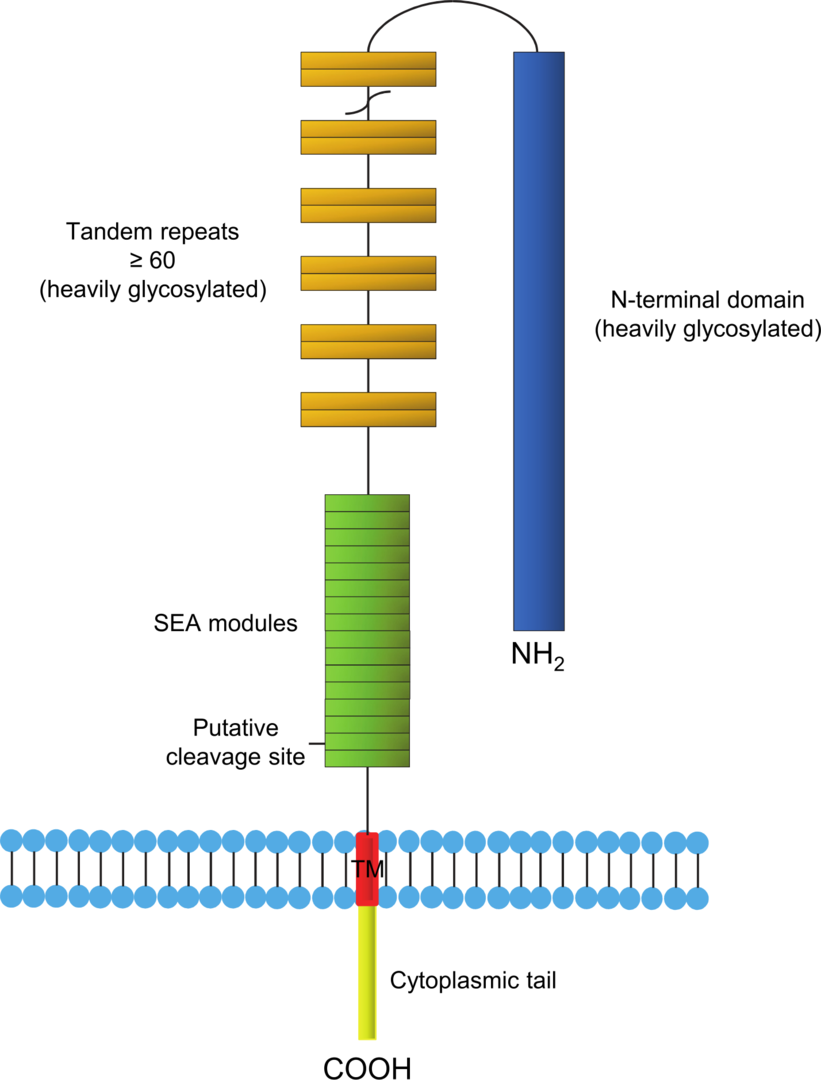
CA125是膜相關的粘蛋白,其具有單個跨膜結構域。CA125的獨特屬性是它的大尺寸。CA125是MUC1和MUC4的兩倍多,含有約22,000個胺基酸,使其成為最大的膜相關粘蛋白。
CA125由三個不同的域組成:
一個N端結構域
串聯重複域
一個C端域
N-末端和串聯重複結構域都是完全胞外和高度O-糖基化的。所有的粘蛋白都含有一個串聯重複結構域,該結構域具有重複的胺基酸序列,這些胺基酸序列在絲氨酸、蘇氨酸和脯氨酸中含量很高。C端結構域包含多個細胞SEA(海膽精子蛋白、腸激酶和agrin)模組、跨膜結構域和胞質尾部。CA125的胞外區可以通過蛋白水解裂解從細胞表面釋放出來。CA125被認為是從SEA模組的一個位點上裂解的。
功能
CA125是眼表面(包括角膜和結膜),呼吸道和女性生殖道上皮的組成部分。由於CA125是高度糖基化的,因此它產生親水環境,其作為上皮細胞頂膜上的外來顆粒和感染因子的潤滑屏障。此外,已顯示CA125的細胞質尾部通過結合ERM蛋白家族的成員與細胞骨架相互作用。已顯示粘蛋白16的表達在乾眼症中有所改變,囊性纖維化和幾種類型的癌症。
作為標誌物
CA-125是最常用的生物標誌物用於卵巢癌檢測。包括美國婦產科醫師大會在內的醫學協會建議對患有卵巢癌平均風險的女性進行常規CA-125篩查或其他篩查。這種情況的原因包括證據表明,模糊測試結果更有可能導致進一步的侵入性,有害和不必要的醫療保健,而不是可能檢測到平均患有卵巢癌的婦女的卵巢癌。
大約90%患有晚期卵巢癌的女性血清中CA-125水平升高,使得CA-125成為症狀出現後檢測卵巢癌的有用工具。監測CA-125血清水平也可用於確定卵巢癌對治療的反應(無病生存時間與CA-125下降速度相關)和預測患者治療後預後。這是因為治療期間持續存在高水平的CA-125與患者的存活率較低有關。此外,緩解期個體內CA-125水平的增加是卵巢癌復發的強有力預測因子。事實上,CA-125水平的上升可能先於疾病復發的臨床證據,間隔為3至6個月。
預後涉及初始和治療後CA-125值。術前值> 65 U / mL表明預後不良。化療後持續升高表明預後不良。化療後CA-125的半衰期與預後相關(CA-125半衰期<20天的患者存活率提高)。歸一化時間(CA-125的下降速率)影響預後,化療的3個周期內更快速的正常化與改善的存活相關。
2011年4月,英國國家健康與臨床卓越研究所(NICE)建議,應該為患有卵巢癌症狀的女性提供CA-125血液檢測。本指南的目的是在治療更有可能成功的早期階段幫助診斷疾病。然後,血液中標記物水平較高的婦女將接受超音波掃描,以確定是否需要進一步檢查。
在一個病例中,在患有IgE骨髓瘤的男性患者中觀察到升高的CA-125血清水平,然而需要更多病例來確定CA-125在骨髓瘤中的臨床意義。
早期發現卵巢癌
CA-125在卵巢癌早期檢測中的潛在作用是有爭議的,尚未被廣泛用於無症狀婦女的篩查工作。使用CA-125生物標誌物的主要問題是缺乏敏感性,尤其是檢測卵巢癌的早期階段,以及缺乏特異性,尤其是在絕經前婦女中。這些局限性意味著CA-125檢測通常會給卵巢癌帶來假陽性,並使患者通過不必要的進一步篩查(有時包括手術)和焦慮。此外,這些局限性意味著許多患有早期卵巢癌的女性將從CA-125檢測中獲得假陰性而不能進一步治療其病情。
特異性和敏感性
CA-125對卵巢癌的特異性有限,因為在沒有卵巢癌的個體中可以發現CA-125水平升高。例如,雖然CA-125最好為用於標記已知卵巢癌,它也可以在其它癌症,包括升高的子宮內膜癌,輸卵管癌,肺癌,乳腺癌和胃腸癌。CA-125也可能在許多相對良性的病症中升高,例如子宮內膜異位症,卵巢的幾種疾病,月經和懷孕。在腹部區域存在任何炎症性疾病,包括癌症和良性,以及肝硬化和糖尿病時,它也會升高。因此,CA-125測試不完全具體為卵巢癌和經常導致誤報。
CA-125的特異性在絕經前婦女中特別低,因為在該人群中可見許多導致CA-125水平波動的良性病症,例如月經,懷孕和盆腔炎。
CA-125測試對於檢測卵巢癌也不是非常敏感,因為並非每個癌症患者的血液中CA-125水平都會升高。例如,所有卵巢癌的79%是陽性的CA-125,而其餘不表達該抗原在所有。此外,只有約50%的早期卵巢癌患者CA-125水平升高,這意味著CA-125在症狀出現之前對卵巢癌的敏感性特別差。敏感性差意味著使用CA-125檢測卵巢癌(特別是在疾病的早期階段)可能經常導致假陰性。接受假陰性的患者不太可能尋求進一步治療他們的疾病。
卵巢癌的範圍
雖然該測試通常不被醫學界認為對大規模篩查有用,但高值可能表明該女性應該接受進一步的診斷篩查或治療。正常值範圍為0到35(U / mL)。絕經後婦女的水平升高通常表明需要進一步篩查。在絕經前的女性中,由於許多非癌症原因導致數值經常升高,因此測試不太可靠,並且高於35的值不一定是引起關注的原因。
在由於存在附屬檔案/骨盆腫塊而臨床選擇進行測試的患者中,CA-125對於區分良性和惡性過程具有很大的實用性。在具有可觸及的附屬檔案質量和CA-125水平大於65U / mL的絕經後婦女中,卵巢惡性腫瘤的陽性預測值> 95%。對於臨床上未經過精心挑選的患者,該測試的效用降低,因此突出了仔細進行臨床檢查的必要性。
在癌症中的作用
已經顯示MUC16(CA-125)通過幾種不同的機制在促進腫瘤發生和腫瘤增殖中發揮作用。
免疫系統逃避
MUC16幫助腫瘤生長的一種方式是抑制自然殺傷細胞的反應,從而保護癌細胞免受免疫反應。MUC16可以保護腫瘤細胞免受免疫系統侵害的進一步證據表明,MUC16的高度糖基化的串聯重複結構域可以與半乳糖凝集素-1(一種免疫抑制蛋白)結合。
轉移侵襲
MUC16也被認為參與能夠使腫瘤細胞轉移的細胞間相互作用。這證據表明MUC16選擇性結合間皮素,間皮素是一種通常由腹膜間皮細胞(腹腔內壁)表達的糖蛋白。MUC16和間皮素相互作用被認為是腫瘤細胞侵入腹膜的第一步。區域(殘基296-359),其由在細胞表面間皮素的N末端64個胺基酸已被實驗確立為MUC16 / CA125的功能性結合結構域(命名為IAB)。由間皮素的IAB結構域和人Fc部分組成的免疫粘附素具有破壞由MUC16-間皮素相互作用介導的異型癌細胞粘附的能力。
還發現間皮素在幾種類型的癌症中表達,包括間皮瘤,卵巢癌和鱗狀細胞癌。由於皮素也由腫瘤細胞,表達MUC16和間皮的相互作用可能在其它的腫瘤細胞的聚集有助於向轉移的位置,從而增加了轉移的大小。
誘導運動
有證據表明,MUC16細胞質尾部的表達使腫瘤細胞生長,促進細胞運動並可能促進侵襲。這似乎是由於MUC16的C末端結構域促進信號傳導的能力,所述信號傳導導致E-鈣粘蛋白的表達降低並且增加N-鈣粘蛋白和波形蛋白的表達,這是與上皮細胞一致的表達模式。間充質細胞轉化。
化療耐藥
MUC16還可能在降低癌細胞對藥物治療的敏感性方面發揮作用。例如,已顯示MUC16的過表達保護細胞免受基因毒性藥物(例如順鉑)的影響。