基本介紹
- 中文名:碳酸錳
- 外文名:Manganese(II)carbonate,Manganouscarbonate
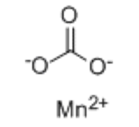
- 化學式:MnCO3
- 相對分子質量:114.95
簡介
質檢信息
| 質檢項目 | 項目指標值 |
|---|---|
硝酸不溶物 | ≤0.03% |
含量(以Mn計) | 44.0~48.0% |
重金屬(以Pb計) | ≤0.004% |
鐵(Fe) | ≤0.005% |
鋅(Zn) | ≤0.05% |
鹼金屬及鹼土金屬(以硫酸鹽計) | ≤1.5% |
總氮量(N) | ≤0.1% |
氯化物(Cl) | ≤0.01% |
硫酸鹽(SO4) | ≤0.02% |


| 質檢項目 | 項目指標值 |
|---|---|
硝酸不溶物 | ≤0.03% |
含量(以Mn計) | 44.0~48.0% |
重金屬(以Pb計) | ≤0.004% |
鐵(Fe) | ≤0.005% |
鋅(Zn) | ≤0.05% |
鹼金屬及鹼土金屬(以硫酸鹽計) | ≤1.5% |
總氮量(N) | ≤0.1% |
氯化物(Cl) | ≤0.01% |
硫酸鹽(SO4) | ≤0.02% |
是製造電信器材軟磁鐵氧體,合成二氧化錳和製造其他錳鹽的原料。用作脫硫的催化劑,瓷釉、塗料和清漆的顏料。也用作肥料和飼料添加劑。用於醫藥,電焊條輔料等,用作...
碳酸錳礦產於地下深部的岩石中的礦石。...... 一般所說的錳礦分為兩種,碳酸錳礦和氧化錳礦。中國碳酸錳礦的儲量比較大,而氧化錳礦的品位通常都比較高,碳酸錳主要...
一氧化錳是灰綠色粉末。不溶於水,可溶於酸。用作催化劑,飼料輔助劑,微量元素肥料,也用於醫藥、冶煉、焊接、乾電池的製造等。可由軟錳礦熱還原製得。...
錳,是瑞典化學家、氯氣的發現者舍勒於1774年從軟錳礦中發現的。當時,這種軟錳礦通稱為“Manganese”,舍勒就用這名字作為新元素的名字,即“錳”。...
酸式磷酸錳,又名馬日夫鹽,英文名稱為manganese dihydrogen phosphate,是白色至灰白色或帶微紅色的結晶,能溶於水起水解作用而成絮狀沉澱。...
錳肥,是指具有錳標明量,以提供植物錳養分的肥料。其主要品種有一水硫酸錳和三水硫酸錳。碳酸錳、含錳玻璃肥料、煉鋼含錳爐渣、含錳工業廢棄物和MnEDTA(螯合錳)...
錳污染是指錳對環境的污染。錳是植物必需的微量營養元素。空氣中超過500微克/立方米可造成錳中毒。水中二價錳對人、畜和水生生物的毒性很小。地表水一般為8微克/...
錳金,就是錳合金。其中錳鋼是重要的錳合金,具有很好的機械強度。有很廣泛的用途。...... 此外,碳酸錳是重要的白色顏料,俗稱“錳白”,而硫酸錳在農業上,則用作...
中信大錳礦業有限責任公司是一家成立於2005年8月的中外合資企業,註冊資本5億元,擁有13家分公司和控股公司,員工5000人,為廣西十佳企業。公司錳礦資源豐富,占全國總...
電解金屬錳是用錳礦石經酸浸出獲得錳鹽,再送電解槽電解析出的單質金屬。外觀似鐵,呈不規則片狀,質堅而脆,一面光亮,另一面粗糙,為銀白色到褐色,加工為粉末後呈...
錳產業技術及套用 作者:陳上、吳顯明、張帆 主編叢書名:出版日期:2019年9月書號:978-7-122-34515-8開本:16K 787×1092 1/16裝幀:平版次:1版1次頁數:170頁...
一水硫酸錳是化學物質。白色或淺粉紅色單斜晶系細結晶。易溶於水,不溶於乙醇,加熱到 200℃以上開始失去結晶水,約 280℃時失去大部分結晶水, 700℃時成無水鹽...
玫瑰紅色結晶。密度4.385g/cm3。加熱分解。易溶於水。有潮解性。用氫溴酸處理一氧化錳、碳酸錳或氫氧化錳的溶液經蒸發、室溫下結晶製得。...
錳元素及其化合物有很多的套用,現在具體來了解一些常見的。...... 碳酸錳(Manganese carbonate)又稱錳白,分子式MnCO3,分子量114.95,玫瑰色三角晶系菱形晶體或無...
化學名稱高錸酸錳是一種無機化合物,化學式為Mn(ReO4)2。製備將高錸酸銨和碳酸錳均勻混合併加熱,生成高錸酸錳。 高錸酸錳IUPAC名 錸(VII)酸錳(II)別名偏高...
四氧化三錳是一種黑色四方結晶,別名輝錳、黑錳礦、活性氧化錳,經灼燒成結晶,屬於尖晶石類,離子結構為 ,其中二價和三價錳離子分布在兩種不同的晶格位置上。氧...
無水碘化錳是棕色晶體,相對密度5.0,熔點638℃(真空中),真空中於500℃下升華。溶於水而分解,溶於醇。加熱至80℃分解。...
英文:manganese-iron alloy釋文:是以錳礦石為原料冶煉而成的合金。冶煉不同類型的錳系鐵合金,對礦石中的錳含量和錳鐵比值的要求如表:用於煉鋼生鐵、含錳生鐵、鏡...
碳酸錳法軟錳礦細粉碎與煤粉混合,進行還原焙燒生成氧化錳,用硫酸浸取,所得硫酸錳溶液中和到Ph4~6,沉澱雜質過濾除渣,濾液加硫化鈉淨化,經壓濾,加入碳酸氫銨及晶...
錳在自然界分布很廣,幾乎各種礦石及矽酸鹽的岩石中均含有錳。錳礦最常見的是無水和含水的氧化錳和碳酸錳,現已知的錳礦物有150種,但含錳最高,能大量富集形成...
錳% 氧化錳 富錳礦 I 35 40 II 30 35 III 18 30 貧錳礦石 10-15 18 鐵錳礦石 I 20 25 II 15 20 III 10 15 碳酸錳 富錳礦石 貧錳礦石...
