碳氫化合物氧化是現代化學化工中最重要的反應之一,其是將石油化工初級產品轉化為具有廣泛用途的醫藥、精細化工中間體的重要途徑。
基本介紹
- 中文名:碳氫化合物氧化
- 外文名:Hydrocarbon oxidation
- 領域:工程技術
- 學科:能源工程
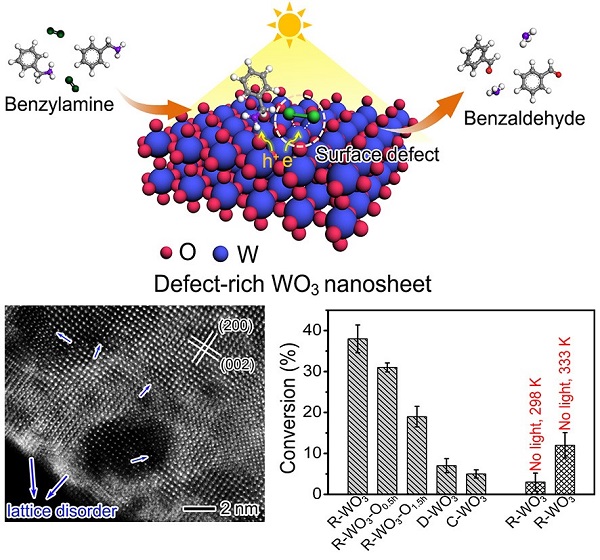
碳氫化合物氧化是現代化學化工中最重要的反應之一,其是將石油化工初級產品轉化為具有廣泛用途的醫藥、精細化工中間體的重要途徑。
碳氫化合物氧化是現代化學化工中最重要的反應之一,其是將石油化工初級產品轉化為具有廣泛用途的醫藥、精細化工中間體的重要途徑。...
碳氫化合物氧化是指常需要使用污染環境的氧化劑或催化劑, 有效利用石油和天然氣資源來生產化學產品的重要途徑。...
碳氫化合物燃料是一種利用人工光合成反應,將二氧化碳轉化為碳氫化合物燃料,這在利用光催化反應實現碳的循環利用方面具有積極的意義。...
直接碳氫化合物固體氧化物重組能得到燃料電池,具有能量密度高和運行成本低等特點。...... 直接碳氫化合物固體氧化物重組能得到燃料電池,具有能量密度高和運行成本低等...
指汽車尾氣排放物中未燃燒的碳氫化合物(HC)的排放。...... 指汽車尾氣排放物中未燃燒的碳氫化合物(HC)的排放...7.碳氫化合物的後期氧化。[1] 參考資料 1. ...
常用的氧化劑有臭氧、過氧化氫、次氯酸鹽、氯氣、二氧化氯、高錳酸鉀和芬頓試劑等。該方法可套用於石油類碳氫化合物、苯、酚類、苯系物、含氯有機溶劑、多環芳烴...
“碳氫”是碳氫化合物通常叫法。僅由碳和氫兩種元素組成的有機化合物稱為碳氫化合物,又叫烴。它和氯氣、溴蒸氣、氧等反應生成烴的衍生物,飽和烴(和苯)不與...
氣體還原 還原劑為H、CO、CH、水煤氣或其他氣態碳氫化合物。如粉末冶金工業經常用氫還原氧化物以製取金屬粉(如W、Mo、Fe等),再壓製成型,燒結成產品。濕法冶金常...
氧化型催化轉化器簡稱DOC,是安裝在發動機排氣管路中,通過氧化反應,將發動機排氣中一氧化碳(CO)和碳氫化合物(HC)轉化成無害的水(H20)和二氧化碳(CO2)的裝置。它...
氧化催化轉換器只將排氣中的CO和HC(碳氫化合物)氧化為CO2和H2O,因此這種催化轉換器也稱做二元催化轉換器。必須向氧化催化轉換器供給二次空氣作為氧化劑,才能使其...
狹義上的有機化合物主要是指由碳元素、氫元素組成,一定是含碳的化合物,但是不包括碳的氧化物和硫化物、碳酸、碳酸鹽、氰化物、硫氰化物、氰酸鹽、碳化物、碳硼烷...
化合物由兩種或兩種以上的元素組成的純淨物(區別於單質)。化合物具有一定的特性,既不同於它所含的元素或離子,亦不同於其他化合物,通常還具有一定的組成。
柴油氧化催化劑,其英文名是Diesel oxidation catalysts,指設計將柴油燃燒後的排放物如一氧化碳、碳氫化合物和SOF,進行氧化,然後產生二氧化碳和水。...
氧化熱裂解又稱部分氧化裂解法或部分燃燒裂解法。是一種將氧化劑混入原料烴,使...熱裂解製程為間接加熱將碳氫化合物分解後重組,將高沸點、巨大分子的有機物質...
完全燃燒是指燃料中所含有的全部可燃物質(碳、氫、硫等)在與氧化合後,只生成...火焰熄滅時油滴的不完全燃燒會產生大量的CO,黑煙和碳氫化合物等大氣污染物,是...
氣態化合物氣態化合物由兩種或兩種以上氣態元素的原子(指不同元素的原子種類)...含碳氫化合物,如硫酸鉛(lead(II)sulphate,PbSO4),分為:酸、鹼、鹽和氧化物...
光化學煙霧(photo-chemical smog)是汽車、工廠等污染源排入大氣的碳氫化合物(HC)和氮氧化物(NOx)等一次污染物在陽光(紫外光)作用下發生光化學反應生成二次污染物...
汽車尾氣污染是由汽車排放的廢氣造成的環境污染。主要污染物為一氧化碳、碳氫化合物、氮氧化合物、二氧化硫、含鉛化合物、苯並芘及固體顆粒物,能引起光化學煙霧等。...
多數揮發性有機物易燃易爆.不安全。.揮發性有機物在陽光照射下.與大氣巾的氮氧化合物、碳氫化合物與氧化劑發生光化學反應.生成光化學炯霧.危害人體健康和作物...
光化學污染,是指光化學煙霧造成的污染。光化學煙霧主要是由於汽車尾氣和工業廢氣排放造成的,汽車尾氣中的烯烴類碳氫化合物和二氧化氮(NO2)被排放到大氣中後,在強烈...
霧島現象中的污染物可以大致分為硫氧化合物、氮氧化合物、碳氫化合物和碳的氧化物等。詞條標籤: 外國行政區劃 , 地理, 地點 V百科往期回顧 詞條統計 瀏覽次數...
廢氣可分為顆粒污染物和氣態污染物,顆粒污染物包括塵粒、粉塵、煙塵、霧塵、煤塵等;氣態污染物包括含硫化合物、含氯化合物、碳氧化合物、碳氫化合物、鹵氧化合物...
在催化劑的作用下,使有機廢氣中的碳氫化合物在溫度較低的條件下迅速氧化成水和二氧化碳,達到治理的目的。催化燃燒法處理工業有機廢氣是20世紀40年代末出現的技術。...
污染大氣的主要有害物質有硫的氧化物、氮的氧化物、碳氫化合物、碳的氧化物、氟化物、氯和氯化物、惡臭物質和浮游粒子等。化工廢氣對大氣的污染特點有以下幾個...
三元催化器的工作原理是:當高溫的汽車尾氣通過淨化裝置時,三元催化器中的淨化劑將增強CO、碳氫化合物和NOx三種氣體的活性,促使其進行一定的氧化-還原化學反應,其中CO...
光化學煙霧污染是汽車、工廠等污染源排入大氣的碳氫化合物(HC)和氮氧化物(NOx)等一次污染物在陽光(紫外光)作用下發生光化學反應生成二次污染物,參與光化學反應...
