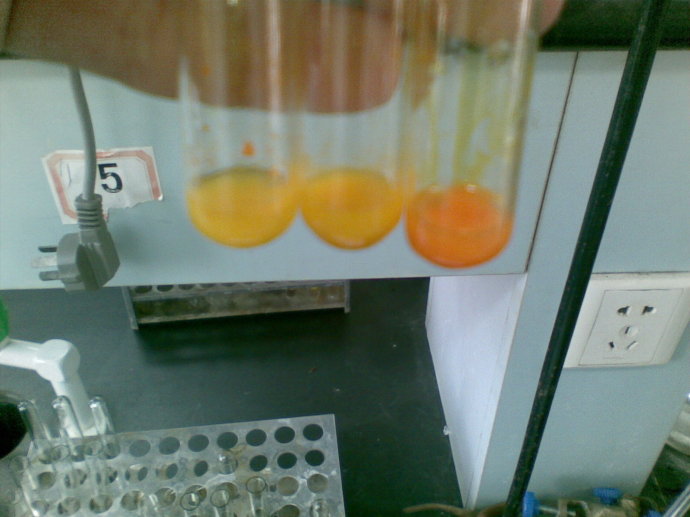
碘仿是不溶於水的淺黃色晶體,並且具有特殊的氣味,很容易識別。將乙醛( 或者甲基酮) 與碘的氫氧化鈉溶液作用,很快便有明顯的淺黃色沉澱析出,即碘仿析出,所以稱這個反應為碘仿反應。
基本介紹
- 中文名:碘仿反應
- 外文名:Iodoform reaction
- 反應物:甲基酮類化合物
- 生成:氯仿、溴仿
- 具有:特殊的氣味
- 沉澱情況:淺黃色沉澱析出
反應機理,試樣的純度要求,碘溶液的用量,溶液的鹼度,反應條件的控制,
反應機理
對具有CH3CO-結構醛、酮進行了碘仿反應實驗, 實驗結果如下:
 表一
表一從表1 的實驗結果可以看出, 具有CH3CO-結構的物質不一定能發生碘仿反應。醛類只有乙醛能發生碘仿反應,酮類中丙酮、低級脂肪酮、苯乙酮都能明顯地觀察到碘仿生成;隨著碳原子數的增加,碘仿反應逐漸減弱,高級脂肪甲基酮及2,6-二甲基苯乙酮看不到碘仿生成。這可以從碘仿反應的反應歷程及反應機理得到滿意的解釋。碘仿反應的反應歷程及反應機理:
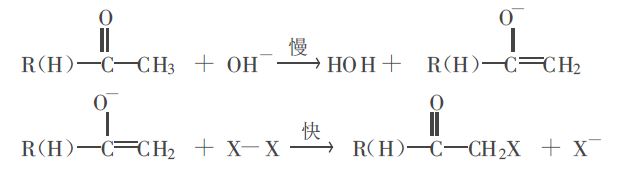 圖一
圖一生成的一鹵代酮的α-質子酸性更強,更易被鹼奪走,所以會繼續反應生成二鹵代化合物,且其反應速度比酮生成一鹵代化合物的速度還要快,直至生成三鹵代物。
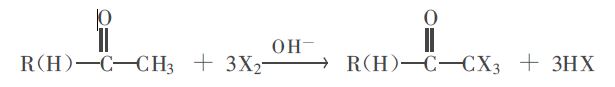 圖二
圖二三碘甲基酮在鹼作用下發生α-斷裂,生成碘仿。該過程首先是OH-對羰基進行加成,羰基碳原子由sp2雜化轉化為sp3雜化,然後發生α-斷裂,生成碘仿。
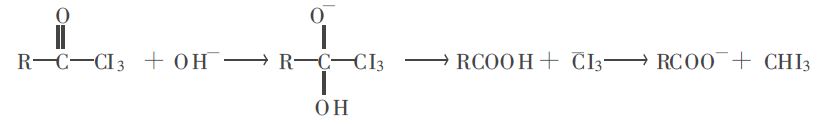 圖三
圖三從碘仿反應的反應歷程和反應機理可以看出,隨著酮的碳原子數的增加,水溶性降低, 生成烯醇負離子的反應活性降低,所以發生碘仿反應的程度逐漸下降;再者,在三碘甲基酮在鹼作用下發生α-斷裂過程中,羰基碳原子要由sp2雜化轉化為sp3雜化,空間位阻影響碳原子構型轉變,空間位阻增大,導致-OH對羰基加成難以進行,所以苯乙酮能明顯地觀察到碘仿生成,而2,6-二甲基苯乙酮看不到碘仿生成。
試樣的純度要求
用工業純的乙醛和化學純的乙醛各1mL,分別滴加同量的I2-NaOH試劑,振盪數分鐘後,發現化學純乙醛先有黃色沉澱析出。同理,用甲基酮等試樣做同樣的試驗,結果相同。上述事實說明,樣品的純度乃是本實驗的關鍵。因此,實驗過程中遇到“異常”現象時,首先檢查樣品是否用錯或樣品的純度。
碘溶液的用量
用同體積的某種化學純試樣(如乙醛),滴加不同數量的碘溶液,並加人同量的5%NaOH溶液,使其充分反應,結果發現碘溶液用量太少時,不出現黃色沉澱;而碘溶液用量太多時,整個溶液呈紫色,難於觀察黃色沉澱析出。這是因為碘溶液本身呈明顯的紫色,如果碘溶液超過乙醛反應所需的量,則過剩的碘溶液就呈紫色,造成乙醛與I2-NaOH溶液反應不出現黃色沉澱的“異常”現象。因此,本實驗中碘溶液的用量不宜太少,但也不宜太多,一般應與試樣同量即可,否則,將導致實驗失敗。
溶液的鹼度
為了做好本實驗,在保證了試樣的純度和碘溶液的用量之後,還有一步是很重要的,即溶液的鹼度大小,用量多少。用3mL的化學純試樣(如乙醛),加人3mL碘溶液,再將此溶液分裝到3個試管中,分別滴加不同量的5%NaOH溶液。其中一個試管中的鹼度適中,即滴加鹼溶液時,控制在碘的紫色剛好消失為止,其餘的一個較其過量,另一個較其少量。結果發現,鹼度適量的試管中有很明顯的黃色沉澱,而其餘二者均無此現象。這是因為鹼度過量時,生成的碘仿又被過量的鹼所分解,而鹼度太小時,碘的紫色退不去,難於觀察沉澱析出。所以,實驗中鹼量切勿加多,也不能加少,而應控制在碘的紫色剛好退去,否則,難於得到正確的結果。
反應條件的控制
在兩支試管中分別裝入1mL乙醛和1mL乙醇,再加人1mL碘溶液及適量的5%NaOH溶液,結果發現,裝有乙醛的試管中很快出現了黃色沉澱,而乙醇的試管中無黃色沉澱,儘管不斷振盪,現象仍不明顯,但是,改變反應條件,即將其放人50-60℃的水浴中加熱幾分鐘,取出冷卻後,便有明顯的黃色沉澱析出。這是因為乙醇與乙醛的結構不同,故發生反應時的速度和條件也就不同了。乙醇之所以能發生碘仿反應是因為乙醇能被I2-NaOH溶液(也是一種氧化劑)所氧化,首先生成乙醛,然後進行碘仿反應,即:反應中加熱的目的是促使醇的反應加快完成,得到乙醛或甲基酮,進而發生碘仿反應。但應注意:加熱的水浴溫度不可過高,否則,氧化產物不是醛酮類,而是梭酸類,也將使實驗出現“異常”現象。若想成功地做好碘仿反應的實驗,必須在以上幾個方面加以注意,以便正確地鑑定或區分乙醛或甲基酮以及含有某些醇類化合物。