硫可以得到2個電子,形成帶兩個單位負電荷的硫離子。(得一個電子則形成過硫離子)
硫離子水解比較完全,在稀溶液中主要以OH-和HS-的形式存在。
基本介紹
- 中文名:硫離子
- 電子:2個
- 負電荷:兩個單位
- 繁體:硫離子
硫離子的含義
硫離子的性質
2H2S + SO2 = 3S + 2H2O
S2-+ Fe2+= FeS↓
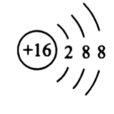
硫可以得到2個電子,形成帶兩個單位負電荷的硫離子。(得一個電子則形成過硫離子)
硫離子水解比較完全,在稀溶液中主要以OH-和HS-的形式存在。
硫可以得到2個電子,形成帶兩個單位負電荷的硫離子。(得一個電子則形成過硫離子)硫離子水解比較完全,在稀溶液中主要以OH-和HS-的形式存在。...
離子符號:在元素符號右上角表示出離子所帶正、負電荷數的符號。 例如,鈉原子失去一個電子後成為帶一個單位正電荷的鈉離子用“Na+”表示。氯原子獲得一個電子後...
利用陽離子與陰離子產生的化學反應,根據所產生的化學現象,判斷陰陽離子。...... 硫離子(S2-)與Pb(NO3)2溶液反應,生成黑色的PbS沉澱。碳酸根離子(CO32-)與BaCl2...
銀/硫離子電極能夠快速、 簡單、精確、經濟地測量水溶液中的銀離子和硫離子。但由於硫化銀為不溶物,所以實 際上銀離子和硫離子不會同時存在於溶液中。 此電極...
鋰硫電池是鋰電池的一種,截止2013年尚處於科研階段。鋰硫電池是以硫元素作為電池正極,金屬鋰作為負極的一種鋰電池。單質硫在地球中儲量豐富,具有價格低廉、環境...
硫肥,是指具有硫標明量的肥料。主要有元素硫(即硫黃)。硫黃施入土壤以後,經硫細菌氧化形成硫酸鹽,其中的硫酸根離子可被作物直接吸收利用。此外還有石膏、硫銨、...
碘三離子,主要指三碘陰離子——I₃⁻,一種由3個碘原子構成的多碘離子。含有這種離子的化合物有三碘化鉈和三碘化銨([NH4][I3])。這些化合物中只有單個...
無機化學中,硫化物(sulfide)指電正性較強的金屬或非金屬與硫形成的一類化合物。大多數金屬硫化物都可看作氫硫酸的鹽。由於氫硫酸是二元弱酸,因此硫化物可分為...
多硫化物是含多硫離子的化合物。鹼金屬、鹼土金屬的硫化物或硫化銨與硫作用可得到多硫化物。隨著硫原子的增多,顏色由黃逐漸漸變深到橙色直至紅色。...
硫化銅是一種無機化合物,化學式為CuS或CuI2CuII(S2)S,故實際上其中有三分之二的硫為過硫離子,三分之二的銅為亞銅離子,呈黑褐色,極難溶,是最難溶的物質...
4.硫化氫遇眼和呼吸道黏膜表面的水份後分解,並與組織中的鹼性物質反應產生氫硫基、硫和氫離子、氫硫酸和硫化鈉,對黏膜有強刺激和腐蝕作用,引起不同程度的化學性...
催化劑的作用是還原硫黃成為負二價硫離子進攻對二氯苯引發反應,反應式如下,因此催化劑須具有較強的還原性,而且不會影響後續鏈增長反應。...
芥子氣,即二氯乙基硫( 2,2'-二氯二乙硫醚,β,β'-二氯二乙硫醚,二(2-氯乙基)硫;dichlorodiethyl sulfide,dichloroethylsulfide,bis(2-chloroethyl)sulfide)的...
硫酸鹽,是由硫酸根離子(SO42- )與其他金屬離子組成的化合物,都是電解質,且大多數溶於水。硫酸鹽礦物是金屬元素陽離子(包括銨根)和硫酸根相化合而成的鹽類。...
氫硫酸是溶液,屬混合物,含有不同的分子和離子(硫化氫分子、水分子、氫離子、硫氫根離子、硫離子、極少量氫氧根離子)。氫硫酸可表現出酸性和還原性,所以氫硫酸不...
在此工藝流程中,硫熏強度為蔗汁吸收SO量的指標,一般用碘滴定法,以10毫升硫熏汁消耗的N/32碘液毫升數表示。 亞硫酸法工藝原理主要是利用亞硫酸離子與鈣離子反應...
配體(ligand,也稱為配基)是一個化學名詞,表示可和中心原子(金屬或類金屬)產生鍵結的原子、分子和離子。 一般而言,配體在參與鍵結時至少會提供一個電子。配體...
像Na+、K+、NH4+、Mg2+、Ca2+、Ba2+這樣的陽根離子會向負極端移動聚集,以氯離子Cl- 硫離子S2- 氫氧根OH-的陰離子就會聚結在正極。形成了正極出酸性水,...
