相率是多相體系中的相數、組分數與溫度、壓力、組成等因素相互依存與變化的規律。是熱力學平衡體系普遍遵守的基本規律。
基本介紹
- 中文名:相率
- 外文名:phase rule
- 領域:熱力學
- 屬性:平衡體系普遍遵守的基本規律
- 相關名詞:三相
簡介,基本概念,歷史,相率的計算,單組分系統相率分析,二組分相率分析,注意事項,
簡介
相率是多相體系中的相數、組分數與溫度、壓力、組成等因素相互依存與變化的規律。是熱力學平衡體系普遍遵守的基本規律。
基本概念
體系內部物理和化學性質完全均勻的部分稱為相。相與相之間在指定條件下有明顯的界面,在界面上巨觀性質的改變是飛躍式的。
體系中相的總數稱為相數,用P表示。
(1)氣體,不論有多少種氣體混合,只有一個氣相。
(2)液體,按其互溶程度可以組成一相、兩相或三相共存。
(3)固體,一般有一種固體便有一個相。兩種固體粉末無論混合得多么均勻,仍是兩個相(固體溶液除外,它是單相)。
(4)固溶體:固態合金中,在一種元素的晶格結構中包含有其它元素的合金相稱為固溶體。在固溶體晶格上各組分的化學質點隨機分布均勻,其物理性質和化學性質符合相均勻性的要求,因而幾個物質間形成的固溶體是一個相。
(5)相平衡體系∶在巨觀上沒有任何物質從一相轉移到另一相的體系。
歷史
吉布斯(Jsoiah Willard Gibbs,1839-1903年),美國理論物理學家。1875-1878年,先後分兩部分在康乃狄克(州)科學院學報(Trans. Conn. Acad. Sci.)上發表 《關於多相物質的平衡》的文章,總計約400頁,約700多個公式。吉布斯的“相率”對於多相體系是“放置四海而皆準”的具有高度概括性的普適規律。它的重要意義就在於推動了化學熱力學及整個物理化學的發展,也成為相關領域諸如冶金學和地質學等的重要理論工具。
相率的計算
相率的數學表達式:

相率是相平衡體系中揭示相數φ,獨立組分數C和自由度 f 之間關係的規律,可用上式表示。式中2通常指T,p兩個變數。相率最早由Gibbs提出,所以又稱為Gibbs相率。
單組分系統相率分析
 單組分系統相率分析
單組分系統相率分析結論:單組分體系,相數最多為3,自由度最多為2。雙變數體系的相圖可用平面圖表示。
二組分相率分析


(1)保持溫度不變,得 p-x 圖 較常用
(2)保持壓力不變,得 T-x 圖 常用
(3)保持組成不變,得 T-p 圖 不常用。
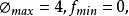
注意事項
1. 相率是根據熱力學平衡條件推導而得,因而只能處理真實的熱力學平衡體系,不能預告反應動力學(即反應速度問題)。
2. 相率表達式中的“2”是代表外界條件溫度和壓強。如果電場、磁場或重力場對平衡狀態有影響,則相率中的“2”應為“3”、“4”、“5”。如果研究的系統為固態物質,可以忽略壓強的影響,相律中的“2”應為“1”。
3. 必須正確判斷獨立組分數、獨立化學反應式、相數以及限制條件數,才能正確套用相率。
4.只表示系統中組分和相的數目,不能指明組分和相的類型和含量。
5. 自由度只取“0”以上的正值。如果出現負值,則說明系統可能處於非平衡態。

