熵增定律是克勞修斯提出的熱力學定律,克勞修斯引入了熵的概念來描述這種不可逆過程,即熱量從高溫物體流向低溫物體是不可逆的,其物理表達式為:S =∫dQ/T或ds = dQ/T。
基本介紹
- 中文名:熵增定律
- 表達式:S =∫dQ/T或ds = dQ/T
- 提出者:克勞修斯
- 套用學科:熱力學
- 適用領域範圍:孤立系統
- 定律內容:熱量從高溫物體流向低溫不可逆
定律公式
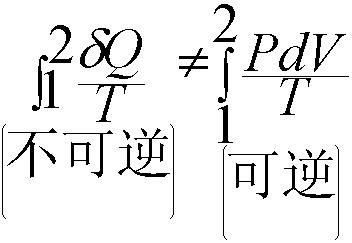
熵增定律是克勞修斯提出的熱力學定律,克勞修斯引入了熵的概念來描述這種不可逆過程,即熱量從高溫物體流向低溫物體是不可逆的,其物理表達式為:S =∫dQ/T或ds = dQ/T。
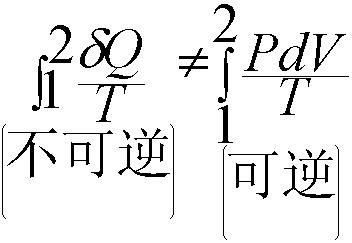
熵增定律是克勞修斯提出的熱力學定律,克勞修斯引入了熵的概念來描述這種不可逆過程,即熱量從高溫物體流向低溫物體是不可逆的,其物理表達式為:S =∫dQ/T或ds = dQ...
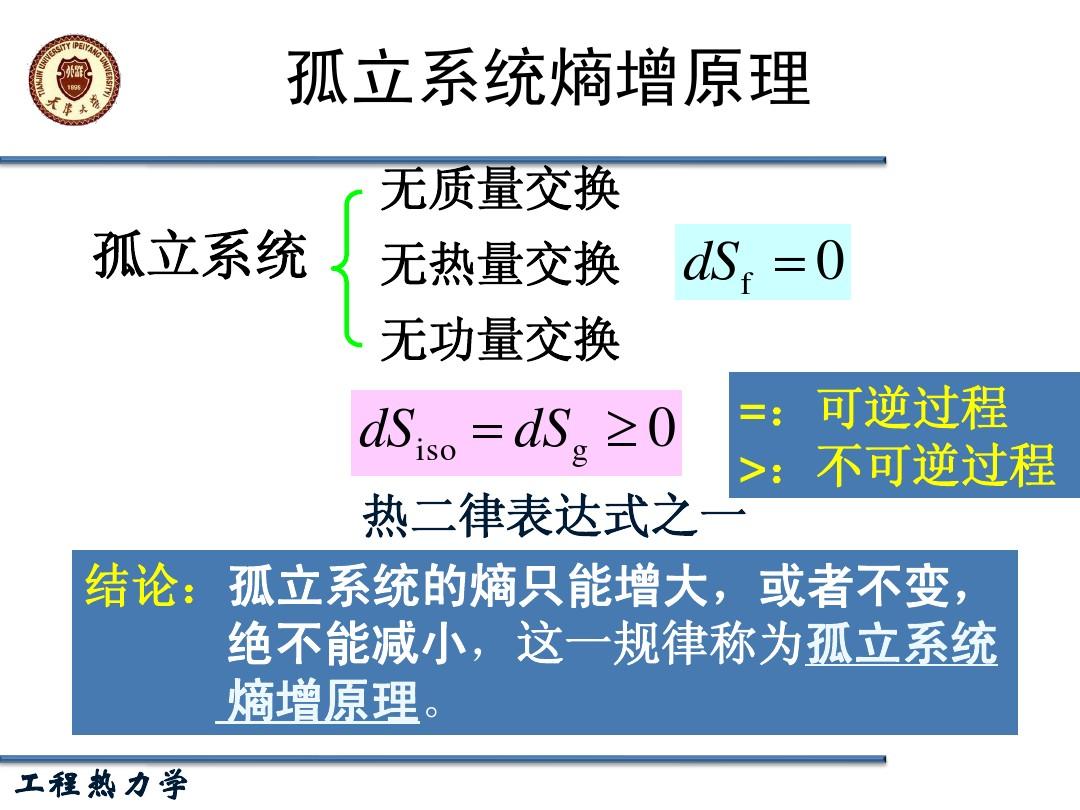
熵增原理就是孤立熱力學系統的熵不減少,總是增大或者不變。用來給出一個孤立系統的演化方向。說明一個孤立系統不可能朝低熵的狀態發展即不會變得有序。...
熵定律是科學定律之最,這是愛因斯坦的觀點。我們知道能源與材料、信息一樣,是物質世界的三個基本要素之一,而在物理定律中,能量守恆定律是最重要的定律,它表明了...
物理定義:熵增過程是一個自發的由有序向無序發展的過程(Bortz, 1986; Roth, 1993)。 熱力學定義:熵增加,系統的總能量不變,但其中可用部分減少。統計學定義:熵...
熵增定律僅適合於孤立體系,這是問題的關鍵。雖然從處理方法上講,假定自然界存在孤立過程是可以的。但是從本質上講,把某一事物從自然界中孤立出來,就使理論帶上了...
能量守恆定律(energy conservation law)即熱力學第一定律是指在一個封閉(孤立)系統的總能量保持不變。其中總能量一般說來已不再只是動能與勢能之和,而是靜止能量(...
熵增定律僅適合於孤立體系,這是問題的關鍵。雖然從處理方法上講,假定自然界存在孤立過程是可以的。但是從本質上講,把某一事物從自然界中孤立出來,就使理論帶上了...
人品守恆定律(C.C.L.,law of conservation of character)講的是,人品既不會憑空產生,也不會憑空消失,而是從一種形式轉化為另一種形式,或從一個事物轉移到另...
熵增定律僅適合於孤立體系,這是問題的關鍵。雖然從處理方法上講,假定自然界存在孤立過程是可以的。但是從本質上講,把某一事物從自然界中孤立出來,就使理論帶上了...
然而,耗散結構描述的現象畢竟是局部的,而熵增定律描述的現象是普遍的。熵增所描述的能量轉化規律甚至比能量守恆定律更重要,通俗地講:熵增定律是"老闆",決定著企業的...
