基本概述
石油煉製過程 之一,是在熱的作用下(不用催化劑)使
重質油發生
裂化反應,轉變為裂化氣(
煉廠氣的一種)、
汽油、
柴油的過程。熱裂化原料通常為
原油蒸餾過程得到的重質餾分油或
渣油,或其他石油煉製過程副產的重質油。熱裂化過程廣泛套用於石油煉製過程,用於將大分子裂化為小分子。裂化反應是吸熱反應,但是某些生成焦炭的縮合反應是放熱反應。
工業發現
1912年熱裂化已被證實具有工業化價值。1913年,美國印第安納標準油公司將W.M.伯頓熱裂化法實現工業化。1920~1940年,隨著高壓縮比汽車發動機的發展,高
辛烷值汽油用量激增,熱裂化過程得到較大發展。第二次世界大戰期間及戰後,熱裂化為
催化裂化所取代,雙爐熱裂化大都改造為重質渣油的減粘熱裂化。
熱裂化 - 化學反應
熱裂化反應很複雜。每當重質油加熱到450℃以上時,其大分子分裂為小分子。同時,還有少量疊合、
縮合發生,使一部分分子轉變為較大的分子,熱裂化是按自由基反應機理進行的。在400~600℃,大分子烷烴分裂為小分子的烷烴和烯烴;環烷烴分裂為小分子或脫氫轉化成
芳烴,其側鏈較易斷裂;芳烴的環很難分裂,主要發生側鏈斷裂。熱裂化氣體的特點是甲烷、乙烷-乙烯組分較多;而催化裂化氣體中丙烷-丙烯組分、丁烷-丁烯組分較多。
熱裂化反應的淨反應速率遵循阿倫尼烏斯(Arrhenius)方程:
k=A·e-E/RT
其中,k是單位時間的反應速率,A是頻率因子,E是活化能,T是溫度,R是氣體常數。Nelson提供了從乙烷到瀝青質的所有烴類的熱裂化反應速率數值。
多數石油烴類熱裂化反應的活化能數值為常數,約為55000cal。但是頻率因子隨分子大小和類型的不同而差別較大。熱裂化反應速率隨相對分子質量的增加而增加,隨分子芳香性的增強而減小。熱裂化反應速率和反應溫度呈指數關係。因此轉化率的大小是反應時間和溫度的函式。若原料反應時間足夠長,反應溫度就可以低一些。停留時間從減黏裂化的幾分鐘到延遲焦化的幾小時不等。
工業套用
工業裝置類型主要有雙爐熱裂化和減粘熱裂化兩種。前者的原料轉化率(輕質油收率)較高,大於45%,目的是從各種重質油製取
汽油、
柴油;後者的轉化率較低(20%~25%),目的是降低減壓渣油的
粘度和凝點,以提高
燃料油質量,雙爐熱裂化汽油的
辛烷值和安定性不如催化裂化汽油,目前已不發展;減粘熱裂化在石油煉廠中仍有較廣泛的套用。
雙爐熱裂化
所謂雙爐,是指在流程中設定兩台爐子以分別加熱反應塔的輕重進料,操作時原料油直接進入分餾塔下部,與塔進料油氣換熱蒸出原料中所含少量輕質油和反應產物中的汽油、柴油後,在塔中部抽出輕循環油。塔底為重循環油。兩者分別送往輕油、重油加熱爐(為避免在爐管中結焦,故將輕、重循環油分別在兩爐中加熱到不同溫度),然後進入反應塔進行熱裂化反應。反應溫度為485~500℃,壓力1.8~2.0MPa;反應產物經
閃蒸塔分出裂化渣油後,進入分餾塔分餾。汽油和柴油總產率約為60%~65%。所得柴油凝點-20℃以至-30℃、十六烷值約60(比催化裂化柴油高約20個單位);汽油辛烷值較低(馬達法辛烷值約55~60)且安定性差,熱裂化渣油是生產針狀焦的良好原料。雙爐熱裂化的能耗約1900MJ/t原料(為催化裂化的65%~70%)。
減粘熱裂化
減粘熱裂化是一種淺度裂化過程,用以降低渣油的凝點和粘度以生產
燃料油,從而可以減少燃料油中摻和輕質油的比例。同時,還生產裂化汽油和柴油。減粘熱裂化流程(下圖)有加熱爐式和反應塔式兩種類型,主要差別是前者不設反應塔,熱裂化反應在爐管中進行,加熱溫度高(約450~510℃)、停留時間短(決定於溫度);後者在加熱爐後設反應塔,主要熱裂化反應在反應塔內進行,加熱溫度低(約445~455℃)、停留時間長(10~20min)。兩者產品產率基本相同,輕質油產率約為18%~20%。反應塔式減粘熱裂化的操作
周期較長、能耗較低,是近年來套用較多的一種工藝。
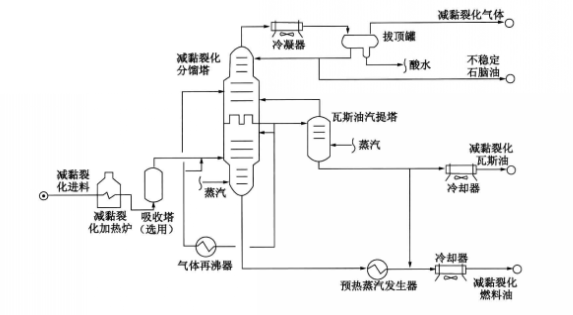 減黏裂化裝置的流程圖
減黏裂化裝置的流程圖石油的熱裂化
石油的熱裂化
石油的熱裂化之一
原理:石油受強熱時,各種飽和烴發生裂化,生成各種相對分子質量較小的不飽和烴和飽和烴。生成的不飽和烴有還原性,能使紫紅色的酸性高錳酸鉀稀溶液褪色。
用品:
分液漏斗、小燒杯、安瓿瓶(或口服液薄壁玻璃瓶)、塑膠眼藥水瓶、酒精燈、細玻璃管、小試管(2支)、市售煤油、濃硫酸、稀氫氧化鈉溶液、酚酞試液、稀高錳酸鉀溶液、銅絲(較粗)。
操作:
1.煤油的精製處理 市售煤油中含有烯烴等雜質,能使稀高錳酸鉀溶液褪色,因此要精製處理後才能做本實驗。取15mL市售
煤油,放在分液漏斗里,加入3mL濃硫酸,塞好塞子後用力振盪約10min(進行間斷放氣)。靜置分層後拔下塞子,打開活塞,把下層棕黃色的濃硫酸排入小燒杯里。在這分液漏斗里再加入3mL濃硫酸,重複上述操作,到下層酸液的顏色明顯變淺。放掉酸層後,用5~10mL稀氫氧化鈉溶液洗一次,再用蒸餾水洗滌幾次,直到放出的水不再使酚酞變紅為止。最後取少量煤油,用稀高錳酸鉀溶液檢驗,如果不褪色就可以用,否則要再次按上述方法洗滌一次。
2.選擇自製儀器,裂化反應器可以選用廢棄的安瓿瓶,或各種精裝口服液用後的薄壁
玻璃瓶等。這類玻璃瓶加熱或冷卻時不易破損。使用前應洗淨、烘乾。取一根較粗的銅絲(或鐵絲),扎住反應瓶,並留出一段作手柄。再取一隻廢棄的塑膠眼藥水瓶,瓶口插一根細
玻璃管,作為吸管。
3.取兩支小試管,各加入2~3mL淺紫紅色的酸性高錳酸鉀稀溶液。其中一支加入幾滴精製煤油,振盪,紅色溶液不褪色。
4.把上述扎住銅絲(或鐵絲)的安培瓶放在酒精燈火焰上加熱到灼熱,離開火焰後迅速滴加2~3滴精製煤油。煤油受強熱後立即裂化、氣化。
5.用自製的吸管從安瓿瓶里吸取裂化氣,把裂化氣移入另一支盛有稀酸性高錳酸鉀溶液的小試管里,邊加入裂化氣,邊振盪試管,溶液的淺紫紅色很快褪盡。
備註:
1.本實驗選用精製煤油代替石油,特點是耗煤油量少(只需2~3滴),加熱時間短(只要十幾秒鐘),實驗器材簡單,現象明顯,成功率高。
2.如果不用自製
吸管,可以用普通滴管代替。但是普通滴管吸取氣體的量較小,要重複操作2~3次。
3.本實驗可以用於演示實驗,也可以用作學生實驗。
石油的熱裂化之二
原理:石油受強熱時,各種飽和烴發生裂化,生成各種相對分子質量較小的不飽和烴和飽和烴。生成的不飽和烴有還原性,能使紫紅色的酸性高錳酸鉀稀溶液褪色。
用品:硬質石英玻璃管、U形管、噴燈、燒杯、鐵架台、石蠟、石棉、銅屑、酸性高錳酸鉀溶液。
操作:
用
酒精噴燈加熱放有銅屑部分的石英玻璃管。銅屑是導熱的,因此石蠟先熔化,再氣化,最後受熱裂化,結果生成液態烴和氣態烴,使高錳酸鉀溶液褪色。
備註:
1.本實驗的關鍵是溫度要高。
2.石英管性能優於玻璃管,操作方便,實驗效果好。
3.控制加熱溫度,切不能過早讓石蠟熔化、氣化,否則得不到液態烴。
重油的熱裂化工藝
是將延遲焦化與緩和熱裂化工藝聯合,即將單程或循環操作的延遲焦化所得焦化油氣分餾得到的焦化蠟油進入反應器內進行緩和熱裂化反應,生成的油氣與焦化油氣一起分餾。氣體、汽油和柴油混合送下游裝置處理,未轉化油返回焦化裝置作循環油。該工藝的
柴油收率比單獨的延遲焦化增加5—15個百分點,柴油的十六烷值可達到50左右。
工藝步驟
(A)重油原料經加熱爐對流段預熱,再通過加熱爐輻射段加熱到焦化溫度進焦炭塔焦化,焦化油氣進入分餾塔分餾;
(B)步驟(A)得到的
蠟油進入另一個加熱爐預熱後,進入反應器進行緩和熱裂化反應;
(C)步驟(B)生成的熱裂化油氣進入步驟(A)中的分餾塔,與焦化油氣一起分餾。
 減黏裂化裝置的流程圖
減黏裂化裝置的流程圖