結構
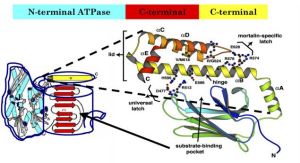
其結構主要由一個N端高度保守的44kuATPase功能域(ATPbindingdomain)和一個分子質量為25ku的C端區域組成。N端ATPase功能域主要由2個大的球形亞功能域(globularsubdomain)Ⅰ和Ⅱ組成,其間被一個深的中央裂縫分開,並通過2個交叉的α螺旋相連線。亞功能域和連線的Ⅱα螺旋在裂縫的底部形成一個核苷酸及所需的Mg2+和K+的結合袋,核苷酸通過與兩個磷酸結合環和一個疏水腺苷的相互作用而定為在活性部位,並與HSC70側鏈結合的Mg2+相聯繫。C端區域又可分為一個保守的15ku的多肽結合功能域(polypeptide-bindingdomain)和一個不保守的靠近C端的10ku可變功能域。Dnak(HSC70)底物結合功能域和部分可變區域重組片斷的結構主要由兩部分組成,第一部分(N端)摺疊成一個緊密的β三明治(β-sandwich)結構;第二部分(C端)由5個α螺旋(α-helices)組成,形成一個鬆弛的α螺旋結構。N端部分的β三明治結構由底部和上部2個片層結構組成,每個片層結構都含有4條反向平行的β摺疊(β-sheet)鏈,其中三明治結構底部片層結構由β3、β6、β7和β8等4條鏈組成,而上部的片層結構由β5、β4、β1和β2等4條鏈組成。不規則的上部片層結構與三明治結構伸出的一些特殊的環(loop,L)聯合形成底物結合位點,L1,2(β1和β2之間形成的)和L3,4(β3和β4)形成一個大小為0.5nm×0.7nm的底物結合通道(substrate-bindingchannel)。
鬆弛構象
鬆弛構象的多肽結合在由β三明治結構形成的底物結合通道中,而α螺旋部分位於多肽結合單位之上,象一個蓋子覆蓋在結合通道上面,而不與底物直接接觸,所以能阻止結合底物的逃脫。 熱激蛋白70 - HSP70的功能 分子伴侶;協同免疫;參與細胞凋亡。
 熱激蛋白70
熱激蛋白70蛋白簡介
熱激蛋白70又稱熱休克蛋白70(heatshockprotein70,HSP70)是一種結構上高度保守的多肽,能夠通過易化變性蛋白的修復,幫助新合成的多肽鍵的生理摺疊與伸展,以及糾正多肽鏈的錯誤摺疊等途徑使細胞的功能和結構得到恢復,具有“分子伴侶(molecularchaperones)”的功能。1962年Ritossa首先在果蠅幼蟲的動物實驗中發現:果蠅唾液腺染色體疏鬆部在過熱環境中發生形態改變。1974年,Tissieres等證實這種形態改變是由於熱休克激發染色體內基因轉錄合成特異性的蛋白,即熱休克蛋白。主要包括兩種蛋白:結構型Hsc70(Heatshockcognate70,p73)和誘導型Hsp70(Heatshockprotein70,p72)。兩者的胺基酸序列90%是相同的,生化特性基本相同(電泳泳動度稍有差異)。
熱激蛋白結構
其結構主要由一個N端高度保守的44kuATPase功能域(ATPbindingdomain)和一個分子質量為25ku的C端區域組成。N端ATPase功能域主要由2個大的球形亞功能域(globularsubdomain)Ⅰ和Ⅱ組成,其間被一個深的中央裂縫分開,並通過2個交叉的α螺旋相連線。亞功能域和連線的Ⅱα螺旋在裂縫的底部形成一個核苷酸及所需的Mg2+和K+的結合袋,核苷酸通過與兩個磷酸結合環和一個疏水腺苷的相互作用而定為在活性部位,並與HSC70側鏈結合的Mg2+相聯繫。C端區域又可分為一個保守的15ku的多肽結合功能域(polypeptide-bindingdomain)和一個不保守的靠近C端的10ku可變功能域。Dnak(HSC70)底物結合功能域和部分可變區域重組片斷的結構主要由兩部分組成,第一部分(N端)摺疊成一個緊密的β三明治(β-sandwich)結構;第二部分(C端)由5個α螺旋(α-helices)組成,形成一個鬆弛的α螺旋結構。N端部分的β三明治結構由底部和上部2個片層結構組成,每個片層結構都含有4條反向平行的β摺疊(β-sheet)鏈,其中三明治結構底部片層結構由β3、β6、β7和β8等4條鏈組成,而上部的片層結構由β5、β4、β1和β2等4條鏈組成。不規則的上部片層結構與三明治結構伸出的一些特殊的環(loop,L)聯合形成底物結合位點,L1,2(β1和β2之間形成的)和L3,4(β3和β4)形成一個大小為0.5nm×0.7nm的底物結合通道(substrate-bindingchannel)。鬆弛構象的多肽結合在由β三明治結構形成的底物結合通道中,而α螺旋部分位於多肽結合單位之上,象一個蓋子覆蓋在結合通道上面,而不與底物直接接觸,所以能阻止結合底物的逃脫。
HSP70的功能
分子伴侶;協同免疫;參與細胞凋亡。
 熱激蛋白70
熱激蛋白70