氫
氫的發現簡史
氫在周期表中的位置
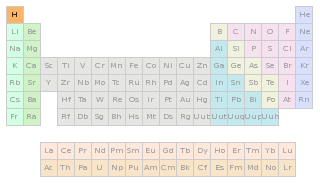 氫在元素周期表中的位置
氫在元素周期表中的位置 氫在元素周期表中的位置
氫在元素周期表中的位置氫是一種化學元素,在元素周期表中位於第一位。氫通常的單質形態是氫氣。它是無色無味無臭,極易燃燒的由雙原子分子組成的氣體,氫氣是最輕的氣體。醫學上用氫氣...
元素符號(symbols for elements)是用來標記元素的特有符號,還可以表示這種元素的一個原子,大多數固態單質也常用元素符號表示。 元素符號通常用元素的拉丁名稱的第一...
過三氧化氫也稱為“三氧化二氫”,其化學式為“H2O3”或“HOOOH”,是氫元素的氧化物。H2O3在常溫下為無色至微紫色液體,易揮發,有魚腥味。是一種不穩定的化...
氫是一種化學元素,在元素周期表中位於第一位。氫通常的單質形態是氫氣。它是無色無味無臭,極易燃燒的由雙原子分子組成的氣體,氫氣是最輕的氣體。醫學上用氫氣...
氫元素是煤中第二重要的元素,主要存在於煤分子側鏈和官能團上,隨煤化程度的提高而呈下降趨勢。煤中氫以符號Hdaf表示(過去用Hr)。是煤中有機質的主要組成元素。...
化學元素周期表是1869年俄國科學家門捷列夫(Dmitri Mendeleev)首創的,他將當時已知的63種元素依原子量大小並以表的形式排列,把有相似化學性質的元素放在同一行,就是...
理論需氧量,Theoretical Oxygen Demand,ThOD 水中某一種有機物的理論需氧量。通常是指將有機物中的碳元素和氫元素完全氧化為二氧化碳和水所需氧量的理論值(即按...
化合價(英語:Valence)是一種元素的一個原子與其他元素的原子化合{即構成化合物}時表現出來的性質。一般的,化合價的價數等於每個該原子在化合時得失電子的數量,即該...
化學式是用元素符號表示純淨物組成及原子個數的式子。分子晶體的化學式叫做分子式,可以表示這種物質的分子構成。...
碳氫元素分析儀是一種主要用於測定煤和其它有機物中碳和氫的含量的儀器。...... 碳氫元素分析儀是一種主要用於測定煤和其它有機物中碳和氫的含量的儀器。...
另種說法是石蠟是幾種高級烷烴的混合物,主要是正二十二烷(C22H46)和正二十八烷(C28H58),含碳元素約85%,含氫元素約14%.沒有單一的化學元素符號。...
金屬氫化物(metal hydride)是由某些金屬元素(鹼金屬元素、除鈹(Be)以外的鹼土金屬元素、部分d區元素和部分f區元素)與氫元素組成的化合物。此類化合物化學性質...
氫元素提供證據重元素分裂產生的氫元素提供了確鑿無疑的證據:奧克羅鈾礦在20億年前確實發生過自持核裂變反應,而且持續時間長達數十萬年。...
氘(deuterium),氫(H)的同位素,也被稱為重氫,元素符號一般為D或2H。氘原子核中有一個質子和一個中子,其相對原子量為普通氫的二倍。氫中有0.02%的氘,在大...
狹義上的有機化合物主要是由碳元素、氫元素組成,是一定含碳的化合物,但是不包括碳的氧化物(一氧化碳、二氧化碳)、碳酸,碳酸鹽、氰化物、硫氰化物、氰酸鹽、金屬...
甲基(methyl group),甲烷分子中去掉一個氫原子後剩下的電中性的一價基團。由碳和氫元素組成。甲基作為一個化學基團(-CH3),它能夠結合在DNA上某些特定部位,這個...
除含碳元素外,絕大多數有機化合物分子中含有氫元素,有些還含氧、氮、鹵素 、硫和磷等元素。已知的有機化合物近600萬種。早期,有機化合物系指由動植物有機...
