基本介紹
- 中文名:朊病毒
- 外文名:prion virus
- 又稱:蛋白質侵染因子
- 屬性:無免疫性疏水蛋白質
- 作用:中樞神經系統
- 舉例:瘋牛病
病毒定義,病毒特性,動物傳播史,認識過程,發現,意義,形態,性質與結構,活動複製機制,致病機制,朊病毒病,傳播途徑,預防,傳染給人,動物致病,假說,研究進展,兩獲殊榮,
病毒定義
病毒特性
朊病毒與常規病毒一樣,有可濾過性、傳染性、致病性、對宿主範圍的特異性,但它比已知的最小的常規病毒還小得多(約30~50nm);電鏡下觀察不到病毒粒子的結構,且不呈現免疫效應,不誘發干擾素產生,也不受干擾作用。朊病毒對人類最大的威脅是可以導致人類和家畜患中樞神經系統退化性病變,最終不治而亡。因此世界衛生組織將朊病毒病和愛滋病並立為世紀之最危害人體健康的頑疾。
動物傳播史
早在三百年前,人類在綿羊和小山羊中首次發現了感染朊病毒病的患病動物。因患病動物的奇癢難熬,常在粗糙的樹幹和石頭表面不停摩擦,以致身上的毛都被磨脫,而被稱為“羊瘙癢症”。該病廣泛傳播於歐洲和澳洲,潛伏期為18到26個月,患病動物興奮、喪失協調性、站立不穩、瘙癢、癱瘓直至死亡。後來又相繼發現了傳染性水貂腦軟化病、馬鹿和鹿的慢性消瘦病、貓的海綿狀腦病等等。經病理性研究表明,這些病都侵犯動物中樞神經系統,隨病程進展,在神經元樹突和細胞本身,特別是在小腦區星形細胞和樹枝狀細胞內發生進行性空泡化,星形細胞膠質增生,灰質中出現海綿狀病變。這些病均以潛伏期長、病程緩慢、進行性腦功能紊亂、無緩解康復、終至死亡為主要特徵。成為人類關注焦點的家畜朊病毒當推1996年春天英國蔓延的“瘋牛病”,它不僅引起英國一場空前的經濟和政治動盪,而且也波及了整個歐洲,加上法國克羅伊茨菲爾德—雅各布氏症(簡稱克雅氏綜合徵,人類的一種朊病毒病)患者增多,人們很自然與食用來自英國的進口牛肉相聯繫,因而引起極大恐慌。儘管後來找出了法國克雅氏綜合症的主要原因是醫源性傳染,但其它一些例證卻又排除不了瘋牛病與人類朊病毒病的關聯性。
認識過程
發現
20世紀60年代,英國生物學家阿爾卑斯用放射處理破壞DNA和RNA後,其組織仍具感染性,因而認為“羊瘙癢症”的致病因子並非核酸,而可能是蛋白質。由於這種推斷不符合當時的一般認識,也缺乏有力的實驗支持,因而沒有得到認同,甚至被視為異端邪說。1947年發現水貂腦軟化病,其症狀與“羊搔癢症”相似。以後又陸續發現了馬鹿和鹿的慢性消瘦病(萎縮病)、貓的海綿狀腦病。最為震驚的當首推1996年春天“瘋牛病”在英國以至於全世界引起的一場空前的恐慌,甚至引發了政治與經濟的動盪,一時間人們“談牛色變”。1997年,諾貝爾生理醫學獎授予了美國生物化學家斯坦利·普魯辛納Stanley B.P Prusiner,因為他於1982年發現發現了一種新型的生物——朊病毒Prion。“朊病毒”最早是由美國加州大學舊金山分校動物病毒學家Prusiner等提出的,在此之前,它曾經有許多不同的名稱,如非尋常病毒、慢病毒、傳染性大腦樣變等。多年來的大量實驗研究表明,它是一組至今不能查到任何核酸,對各種理化作用具有很強抵抗力,傳染性極強,分子量在2.7萬~3萬的蛋白質顆粒,它是能在人和動物中引起可傳染性腦病TSE的一個特殊的病因。
2019年1月,西北農林科技大學生命科學學院分子病毒學課題組在《自然·通訊》雜誌線上發表了題為《一個具有朊病毒特性的病毒表達因子》的論文,該課題組在病毒中發現朊病毒,這一發現或為阿爾茲海默症的防治帶來曙光。
意義
從理論上講,“中心法則”認為DNA複製是“自我複製”,即DNA~DNA,而朊病毒蛋白是PrP→PrP,是為“自他複製”。這對遺傳學理論有一定的補充作用。但也有矛盾,即“DNA→蛋白質”與“蛋白質→蛋白質”之間的矛盾。對這一問題的研究會豐富生物學有關領域的內容;對病理學、分子生物學、分子病毒學、分子遺傳學等學科的發展至關重要,對探索生命起源與生命現象的本質有重要意義。從實踐上講,其對人畜健康;為揭示與痴呆有關的疾病(如老年性痴呆症、帕金森病)的生物學機制、診斷與防治提供了信息,並為今後的藥物開發和新的治療方法的研究奠定了基礎。
朊病毒已經超出了經典病毒學的生物學概念,研究表明,蛋白質在特定條件下發生突變或構型上的變化,由良性變為惡性,即變為具有傳染性的蛋白質顆粒,這一觀點向傳統觀點提出了強有力的挑戰。由朊病毒引起的疾病不斷被發現並相繼被確認,不論在人群中還是在動物群中的發病率在全球範圍內呈上升趨勢,因而對朊病毒的研究不僅有重大的理論意義,同時還有迫切的現實意義。它的理論意義在於開闢了生物醫學研究的一個新領域,要求細胞生物學、分子生物學、分子遺傳學、蛋白質化學、分子病毒學、神經病理學等多學科的緊密合作來回答朊病毒帶來的一系列問題;它的現實意義在於發展準確可靠的診斷技術,全面監測、檢測朊病毒病,特別是做到對瘋牛病和醫源性感染的早期預防。
形態
80年代Merz等人在電子顯微鏡下發現了羊瘙癢病相關纖維是至今朊病毒唯一的可見形態。它是一種特殊的纖維結構,它的存在形式有兩種,Ⅰ型纖維直徑為11~14納米,由兩根直徑為4~6納米的原纖維相互螺旋盤繞而成,螺距為40納米不等;Ⅱ型纖維由4根相同的原纖維組成,每兩根之間的間隙為3~4納米,Ⅱ型纖維的直徑為27~34納米,每100~200納米即出現一個狹窄區,狹窄區的直徑約9~11納米。
性質與結構
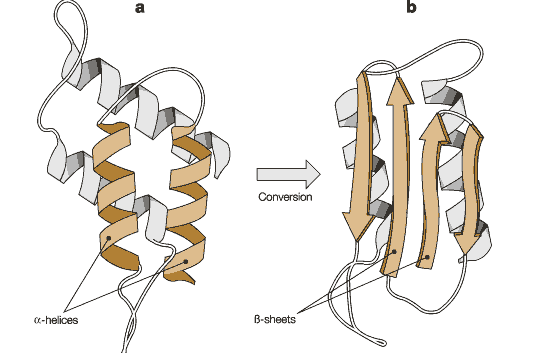
斯坦利·普魯辛納經過多年的研究,終於初步搞清了引起瘙癢病的病原體即朊病毒的一些特點。他發現朊病毒大小只有30-50納米,電鏡下見不到病毒粒子的結構;經負染後才見到聚集而成的棒狀體,其大小約為10~250 x 100~200納米。通過研究還發現,朊病毒對多種因素的滅活作用表現出驚人的抗性。對物理因素,如紫外線照射、電離輻射、超音波以及160~170℃高溫,均有相當的耐受能力。對化學試劑與生化試劑,如甲醛、羥胺、核酸酶類等表現出強抗性。能抵抗蛋白酶K的消化。在生物學特性上,朊病毒能造成慢病毒性感染而不表現出免疫原性(沒有引起免疫系統察覺的原因是,它們的“安全形式”從個體出生的一刻起就存在於體內。 “危險”朊毒體與之的差別只是它們的摺疊結構有差別),正常表達的朊蛋白(PrP)構象的二級結構中α螺旋占42%、β摺疊占3%;而異常構象朊蛋白的α螺旋占3%、β摺疊占43%,具有強致病性。PrP和PrP的一級結構沒有差別,正常動物腦中只有PrPc,沒有PrPBc。PrPc和PrPBc間由α螺旋向β摺疊的轉變即朊病毒蛋白的形成過程。巨噬細胞能降低甚至滅活朊病毒的感染性,但使用免疫學技術又不能檢測出有特異性抗體存在,不誘發干擾素的產生,也不受干擾素作用。總體上說,凡能使蛋白質消化、變性、修飾而失活的方法,均可能使朊病毒失活;能作用於核酸並使之失活的方法不一定導致朊病毒失活。由此可見,朊病毒本質上是具有感染性的蛋白質。普魯辛納將此種蛋白質單體稱為朊病毒蛋白PrP。
活動複製機制
朊病毒具體的活動和複製機制還不是很清楚。
推測朊病毒僅由蛋白質組成,沒有核酸。一種學說認為朊病毒的蛋白質能為自己編碼遺傳信息。這種假說與傳統的分子生物學中的“中心法則”是相違背的,因為朊病毒沒有核酸。於是人們假設朊病毒的複製可能的方法,一認為是通過逆轉譯過程產生為朊病毒編碼的DNA或RNA(如後者情況還需要逆轉錄)必須存在逆轉譯酶,甚至還要有逆轉錄酶。二為蛋白質指導下的蛋白質合成,即蛋白質本身可作為遺傳信息。在這之前,科學家認為所有的病原體都有可複製的核酸(細菌、病毒等等)。
最引起當今科學家興趣和關注的是朊病毒的複製機理。由於朊病毒是一種只含有蛋白質而不含核酸的分子生物並且只能在寄生宿主細胞內生存。因此,合成朊病毒所需的信息,有可能是存在於寄主細胞之中的,而朊病毒的作用,僅在於激活在寄主細胞中為朊病毒編碼的基因,使得朊病毒得以複製繁殖。
研究人員發現了一個突破口:這種具有感染性的因子主要由被稱為PrP的蛋白質組成的。這種蛋白質可以在細胞的質膜上找到(具體功能還不了解),但是具有感染性的因子PrpSC與正常因子PrPC在形狀上有一點不同。科學家推測這種變形的蛋白質會引起正常的PrPC轉變成具有感染性的蛋白質,這種連鎖反應使得正常的蛋白質和致病的蛋白質因子都成為新病毒的材料。在這個假說被提出來以後,產生PrP的基因被抽離出來,產生不同形狀的突變基因被成功的定義和複製,研究實驗鼠的結果為這個假說提供了支持,這些證據是強有力的,但並不是無可爭議的。進一步研究發現,朊病毒蛋白是人和動物正常細胞基因的編碼產物(人的該基因位於第20號染色體短臂)。
致病機制
發病機制都是因存在於宿主細胞內的一些正常形式的細胞朊蛋白發生摺疊錯誤後變成了致病朊蛋白而引起的。
朊病毒通過不斷聚合,形成自聚集纖維,然後在中樞神經細胞中堆積,最終破壞神經細胞。
朊病毒病
除上文提到的幾種由朊病毒引起的疾病均發生在動物身上外,人的朊病毒病已發現有4種:庫魯病Ku-rmm、克——雅氏綜合症CJD、格斯特曼綜合症GSS及致死性家族性失眠症FFI。臨床變化都局限於人和動物的中樞神經系統。病理研究表明,隨著朊病毒的侵入、複製,在神經元樹突和細胞本身,尤其是小腦星狀細胞和樹枝狀細胞內發生進行性空泡化,星狀細胞膠質增生,灰質中出現海綿狀病變。朊病毒病屬慢病毒性感染,皆以潛伏期長,病程緩慢,進行性腦功能紊亂,無緩解康復,終至死亡為特徵。
傳播途徑
對於人類而言,朊病毒病的傳染有兩種方式。其一為遺傳性的,即人家族性朊病毒傳染;其二為醫源性的,如角膜移植、腦電圖電極的植入、不慎使用污染的外科器械以及注射取自人垂體的生長激素等。至於人和動物間是否有傳染,尚無定論,這有待於科學家的進一步研究證實。
朊毒體似乎在直接與受感染的組織接觸時感染性很強。例如,人們可能會因為注射直接來源於人類腦下垂體的生長激素而感染格斯特曼綜合症Creutzfeldt-Jakob疾病或變異性克雅氏病nvCJD,或通過腦部外科手術的儀器傳染(朊病毒可以倖存於通常為外科器械消毒的高壓滅菌器)。通常也認為,食用受感染的動物可以通過積累緩慢地引起疾病,特別是可以引起朊病毒在世代間積累的同類相食或類似的行為,例如太平洋一個小島上發生的庫魯病。雖然這種風險沒有被證明,但是現代農場不接受給反芻動物餵養反芻動物蛋白質粉末就是一個警惕。
預防
由於朊病毒病尚無有效的治療方法,因此只能積極預防。其方法主要有:
①消滅已知的感染牲口,對病人進行適當的隔離
③對有家庭性疾病的家屬更應注意防止其接觸該病。
國家政策:
一是堵漏洞,嚴把海關進出口國門,嚴禁從瘋牛病疫區進口動物源性飼料、生物製品和與牛相關製品;二是查內源,加強對本土羊瘙癢病的篩查,監測瘋牛病,預防醫源感染;三是強基礎,加強對朊病毒發病機理、傳染途徑、滅活消毒手段的研究。如瘟疫爆發,國家應該封鎖國境線、關閉機場與港口,捕殺與其有關聯的動物(中間宿主)。
傳染給人
至今還沒有明確的答案。因為已經證明,不同的動物之間,朊病毒病的傳染是與朊病毒蛋白胺基酸差別程度有關的。瘋牛病的高發是與牛飼料添加劑中存在攜帶朊病毒的綿羊組織密切相關的。牛和羊的朊病毒蛋白有7個胺基酸的差別,而倉鼠與小鼠有16個胺基酸的不同,致使小鼠難於被倉鼠朊病毒感染。牛和人之間有30多個胺基酸的差別,遠遠大於倉鼠與小鼠之間的差別,似乎瘋牛病不可能傳染給人。但是已經證實人朊病毒可傳染小鼠,人與小鼠PrP基因有28個密碼子的區別;在英國已有兩位擁有“瘋牛病”牛的農場主死於克雅氏綜合症。英國4例新發現患者中,其中3位生活在瘋牛病頻發區。因而不能排除瘋牛病傳播給人的可能性。
動物致病
由於朊蛋白分子(PrPc)本身不能致病,而必須發生空間結構上的變化轉化為朊病毒(PrPsc)才會損害神經元。這一變化恰恰是朊病毒脅迫所致的。即一個致病分子先與一個正常分子結合,在致病分子的作用下,正常分子轉變為致病分子,然後這兩個致病分子分別與兩個正常分子結合,再使後者轉變為致病分子。周而復始,通過多米諾效應倍增致病。由此可見,致病的基本條件有二,一是具有朊病毒,二是具有朊病毒蛋白。
上述推測是否有根據?答案是肯定的。動物實驗證明,接種朊病毒可使動物患病。套用基因操作方法去除朊病毒基因的小鼠,即使導入朊病毒也不會感染。
人類格斯特曼綜合症和致死性的家族性失眠症已被確定是由於編碼該蛋白的基因發生了突變,因此具有遺傳性,這些突變致使所編碼的蛋白質結構不穩定,易於轉變為朊病毒。已鑑定到數十個傳播的家族。克雅氏綜合症中10-15%由基因突變所致,現已鑑定到百來個傳播的家族。庫魯病則被確定為傳染性的疾病。
假說
1982年普魯宰納提出的朊病毒致病的“蛋白質構象致病假說”,以後魏斯曼等人對其逐步完善。其要點如下:①朊病毒蛋白有兩種構象:細胞型(正常型PrPc)和搔癢型(致病型PrPsc)。兩者的主要區別在於其空間構象上的差異。PrPc僅存在α螺旋,而PrPsc有多個β摺疊存在,後者溶解度低,且抗蛋白酶解;②Prpsc可脅迫PrPc轉化為Prpsc,實現自我複製,並產生病理效應;③基因突變可導致細胞型PrPc中的α螺旋結構不穩定,至一定量時產生自發性轉化,β片層增加,最終變為Prpsc型,並通過多米諾效應倍增致病。
從這一假說我們可以知道:1、朊病毒是蛋白質,沒有通常我們認為是遺傳物質的DNA、RNA等成分;2、與朊病毒相對應的是具有正常功能的蛋白質,即朊病毒是正常功能的蛋白質空間結構變異所形成。
由於朊病毒並沒有屬於自己的遺傳信息,那么它遺傳信息的必然來源於他的“宿主”的細胞核。因此,朊病毒其實是“宿主”自身的遺傳信息編碼所形成的。編碼朊病毒的遺傳信息,至少在細胞核的染色體基因中是相同的,只是在多肽鏈形成後,還要經過一系列的修飾過程,一種可能是這些修飾過程中的一些過程出現錯誤,導致正常的蛋白質空間結構變異為異常的結構。第二種可能是這一修飾過程也沒有出現錯誤,而是在正常的蛋白質形成後,由於外界因素導致了正常蛋白質的變異,使之成為所謂的“朊病毒”。
所以我們可以把“朊病毒”定義為動物(包括人類)細胞在正常的蛋白質的生成過程中,或正常的蛋白質生成後,由於某一異常因素,而導致了蛋白質空間結構變異所形成的!
由以上定義,我們繼續討論朊病毒的傳染性。據2005年《細胞》雜誌所刊登的美國科學家的結論,利用少量的“朊病毒”分子,可以將大量的正常的蛋白質變為“朊病毒”,即少量變異的蛋白質分子可以將正常構型的蛋白質變為變異的分子。這以結果解釋了為什麼少量“朊病毒”能夠導致機體的功能喪失。
從“朊病毒”的本質來看,它是空間構型改變的正常蛋白質,是正常蛋白質變性所致。
動物體內的蛋白質種類非常的多,功能也有很大的差別,每一種蛋白質的變性都會導致其原有功能的喪失或減弱。由於神經系統的脆弱性,其某一蛋白質組織的變性就可以造成整個系統很大的損壞,從而導致疾病的發生。
迄今為止發現,並不是所有的朊蛋白都是危險的。事實上,它們存在於很多植物和動物中。正因為如此,科學家認為這些變形的蛋白質可能為它們的寄主帶來了一些好處。這個假設在對一種特定的蘚類植物進行研究的時候被證實。正常情況下,當一個地方的蘚與另一個地方的蘚長得足夠它們的外層細胞相互接觸時,病毒會從一個受感染的蘚的部分傳播到另一個沒有受感染的蘚的部分。但是,朊蛋白似乎會繞到被感染的蘚的邊緣部分--這可以引起蘚邊緣部分的細胞死亡,從而形成一個屏障,阻止病毒穿過,使蘚避免受到污染。
1965年,布賴恩科克斯博士BrianCox在酵母中發現了一種只有蛋白質參與的奇怪的遺傳,他們把它稱為[PSI+]因素([PSI+]element)。1994年,美國國立衛生研究院NIH的里德維克尼博士ReedWickner提出假說,認為[PSI+]和另一個遺傳因子[Ure3]都是朊病毒,很快他們注意到熱休克蛋白heat shock proteins(又稱分子伴侶)molecular chaper oneHsp70,Hsp104等可以調控[PSI+]的形成。隨後幾個實驗室的研究顯示出了胺基酸序列如何影響PSI蛋白質Sup35p在它的朊病毒和非朊病毒狀態間轉化。芝加哥大學的SusanLindquist博士認為,朊病毒轉換在某種情況可能是有利的,這使得它們在進化中得以保留。
另外,有關的研究指出朊病毒還可能與細胞分化有關,這個過程由幹細胞推動,把細胞功能專業化(例如肌肉細胞和血細胞)。
研究進展
對朊病毒的研究側重兩個方面。
其一,朊病病毒本身的分子結構、遺傳機制、增殖方式、傳遞的種間屏障、毒株的多樣性等
其二,朊病病毒的致病機理及治療方法等。其中對有些問題已有了實質性的進展。如測定了一些朊病毒蛋白分子結構,建立了分子模型;測定了PrP基因的結構及編碼蛋白的序列,並比較了人、倉鼠、小鼠、綿羊、牛、水貂之間PrP的同源性均高於80%;已測定的25種非人靈長類動物和人PrP序列的同源性為92.9%~99.6%;建立了朊病毒的疾病譜;1994年又發現了新型克一雅氏綜合症(vCJD);1997年WHO TSEs專家會議提出了各種人朊病毒的診斷標準,診斷方法也時有報導,如生物測定法、單克隆抗體法等;2000年2月,美國政府宣布,在用老鼠做實驗後發現,環四吡咯(cyclic tetrapyrrole)可用於治療和預防“瘋牛病”及相關疾病。
儘管朊病毒的研究取得了許多成績,但還有許多問題尚待解決。例如,朊病毒一個感染單位是許多PrPsc分子的聚合物還是若干個PrPsc分子混合物中為數不多的某種特殊分子;PrPc和PrPsc的精確結構及其在轉變中產生的結構變化;體外試驗產生的PrPc有無感染性;毒株多樣性形成的機制;PrP的生理機能;朊病毒進入腦的通路和其與腦病變的關係;朊病毒病的診斷標準、防治藥物、流行趨勢預測等。
兩獲殊榮
有關朊病毒的研究在過去的20世紀諾貝爾獎中曾分別於1976年和1997年兩次獲得諾貝爾生理學或醫學獎。
20世紀50年代初,居住在大洋洲巴布亞紐幾內亞高原的一個叫Fore的部落還處在原始社會,他們一直沿襲著一種宗教性食屍習慣,若干年後(一般5~30年)食屍者中不少人會出現震顫病最終發展成失語直至完全不能運動,不出一年被染者全部死亡。這種現代醫學所說的震顫病,當地土語稱之為“Kuru”。Fore部落原有160個村落、35000人,疾病流行期間80%的人皆患此病,整個民族陷入危亡。50年代後期,在世界衛生組織和澳大利亞政府的干預下禁止了這種人吃人的陋習,發病率逐漸下降。美國國立衛生研究院的Gajdusek和Gibbs與澳大利亞Zigas等人合作共同研究這種震顫性疾病,並通過一系列的實驗證實震顫病與羊瘙癢症、人早老性痴呆屬於同一病原感染,Gajdusek由此獲得1976年諾貝爾生理學和醫學獎。之後,各國科學家在震顫病方面又做了大量的研究工作,發現震顫病是一種神經系統慢性退化性疾病,其病理變化與動物的海綿狀腦病很相似,並成功地構建了動物模型。
美國加州大學神經病學專家StanleyBPrusiner等提出,朊病毒是一種傳染性蛋白質顆粒,不含有核酸,可自身複製,Prusiner憑藉對朊病毒的研究獲得1997年諾貝爾生理學和醫學獎。