簡介,危害記錄,化學性質,分子結構,化學性質,毒理,分子機理,遷移轉化,毒效應,肝毒性,腎毒性,生殖毒性,免疫系統毒性,心臟毒性,致癌機理,毒代動力學,蛋白磷酸酶抑制途徑,損傷遺傳物質,活性氧途徑,其他途徑,水生生物生態毒理學,水生植物生態毒理學,魚類生態毒理學,毒素檢測,生物分析法,物化分析方法,免疫化學法,去除技術,生物法,高級氧化技術,
簡介 微囊藻毒素Microcystins(MC)是由
藍藻 水華,如固氮的魚腥藻(Anabaena)、束絲藻(Aphanizomenon)、擬柱胞藻(Clindrospermopsis)、膠刺藻(Gloeotrichia)和節球藻(Nodularia),非固氮的微囊藻(Microcystis)、顫藻(Oscillatoria)和鞘絲藻(Lyngbya)等暴發所產生的一種肝毒素,它對
蛋白磷酸酶 1 和蛋白磷酸酶2A 具有抑制作用,因此與腫瘤促進作用有直接關係。
藍藻系統發育樹 隨著中國水體的富營養化程度逐漸加劇,藍藻水華和赤潮的發生逐漸增加。80% 的藍藻水華都可以檢測出次生代謝產物---微囊藻毒素(microcystins,MCs),它對水體環境和人群健康的危害已成為全球關注的重大環境問題之一。微囊藻毒素為七肽單環肝毒素,結構中存在著環狀結構和間隔雙鍵,因而具有相當的穩定性。它能夠強烈抑制蛋白磷酸酶的活性,當細胞破裂或衰老時毒素釋放進入水中,同時它還是強烈的肝臟腫瘤促進劑。中國生活飲用水衛生標準(GB 5749-2006)的頒布,將飲用水中微囊藻毒素含量限制為1μg/L,該標準的實施對水源水的質量提出了更高的要求。
危害記錄 歷史上最早的關於微囊藻素對人類的毒害作用可追溯到1000多年前的中國,當時
諸葛亮 記載了他的部隊從中國南部的一條發綠(推測可能是藍藻)的河流中取水飲用而中毒死亡。關於這種藻毒素引起人類腸胃炎的最早報導見於1931年,發生在沿美國Ohio河的一系列城鎮,當時,由於降水量少,Ohio河的一個支流發生了藍藻水華,水華隨後流入幹流,隨著其向下游的移動,引發了一系列的疾病,而這些都不能歸結為傳染源。在辛巴威的Harare市,生活在從一個特定的水庫供水的某一區域的兒童,每年都發生腸胃炎,但找不到感染源,但其時間剛好與該水庫的微囊藻水華分解同步,而在該城市使用其它供水的兒童則未出現腸胃炎。
杭州市某水庫質譜測定 1996年2月巴西一血液透析中心由於使用了含MC污染的水作腎透析液,使126例病人出現急性和亞急性肝毒性的症狀和體徵,造成60人死亡,其中多數死於肝臟衰竭。MC污染還可造成野生動物、家畜、家禽等中毒死亡,已成為當前國際公共衛生學家及生物學家共同關注的熱點課題。
中國也有許多飲用水源發生藍藻水華並檢測出MC,特別是2007年發生了太湖大面積暴發藍藻水華導致震驚世界的無錫市飲用水污染的事件。藍藻污染不僅會惡化水質,還可能釋放出水溶解性肝毒素、神經毒素及其它毒素,其中危害最大的是由銅綠微囊藻、水華魚腥藻和顫藻等藍藻產生的微囊藻毒素(microcystins,MCs)。流行病學調查顯示,飲用水源中微囊藻毒素是中國南方一些地區原發性肝癌發病率高的主要原因之一。
中國天然及水庫水體的MC污染中國是一個湖泊眾多的國家,20 世紀90年代以來,藍藻水華暴發的面積、強度以及藻毒素含量均在大幅度增長,由此帶來的環境和生物安全問題日益引起關注。這其中,以
雲南滇池 、江蘇
太湖 、安徽
巢湖 的藍藻水華污染最為嚴重。此外,長江、黃河、松花江中下游等主要河流以及鄱陽湖、武漢東湖、上海澱山湖等幾大淡水湖泊、水庫中也都相繼發生了不同程度的藍藻水華污染並檢測到了MC的存在,對中國南北幾個省市各水體都有不同程度的MC污染,其中以溝塘水、河水和水庫水最為嚴重。Song等2005年在太湖五里湖和梅梁灣檢測的表層水最大胞外MC含量分別為2. 71和6. 66μg· L-1。Shen等報導太湖梅梁灣的微囊藻毒素隨時間和營養鹽水平的不同有很大差異,胞內毒素最高可達97.32μg·g-1乾藻。徐海濱等對江西鄱陽湖的調查顯示,水體微囊藻毒素最大為1 036. 9pg·ml-1,同時發現魚體內有毒素積累。王紅兵等曾檢測到上海澱山湖水體中MC濃度最高可達55. 4ng·ml-1。2005年對北京市重要飲用水水源地官廳水庫、密雲水庫和懷柔水庫水源水樣進行藻毒素調查發現,在藻類的高發季節,3個水庫水體中均檢出MC,其中官廳水庫7月份MC最高值達到20μg·L-1。廣東省典型供水水庫和淡水湖泊微囊藻毒素分布廣泛,毒素組成以MC-RR為主,水庫微囊藻毒素含量在0-0.919μg·L-1。陳剛等在原發性肝癌高發地區江蘇海門等地的許多溝塘中檢出大量的微囊藻毒素,河水和溝塘水中檢出的MC最高分別達1558pg·ml-1和300pg·ml-1。
巢湖漁民隨機微囊藻素身體測試 化學性質 分子結構 MC是一種單環七肽物質,具有明顯的肝細胞毒性。由於多肽中兩種可變
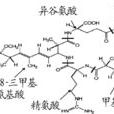
胺基酸 組成的不同,具有多種異構體。其中存在最普遍、含量最多的是MC-LR,MC-RR,MC-YR這3種微囊藻毒素(L、R、Y分別代表亮氨酸、精氨酸和酪氨酸)。國內外研究最多的主要是MC-LR和MC-RR。MC的毒性和其結構相關,Adda是表達MC毒性性的必需基團。研究表明,MC-LR的急性毒性最強,MC-YR次之,MC-RR最弱。
微囊藻素分子結構 MC單環結構分子量在900~1100道爾頓,是水體中最常見的一種藍綠藻毒素。一般結構為環(D-丙氨酸-L-X-赤-β-甲基-D-異天冬氨酸-L-Z-Adda-D-異谷氨酸-N-甲基脫氫丙氨酸)。分子上1位是Ala-右旋-丙氨酸;2,4位上的X和Z分別代表不同的胺基酸;3位上是MeAsp-D-赤-β-甲基天冬氨酸;5位上是(2S,3S,8S,9S)-3-氨基-9-甲氧基-2,6,8-3甲基-10-苯基-4,6-二烯酸,簡稱Adda;6位上是Glu-異谷氨酸;7位上是Mdha-N-甲基脫氫丙氨酸或Dha-脫氫丙氨酸。其中,Adda(3-氨基-9-甲氧基-2,6,8-三甲基-10-苯基-4,6-二烯酸,3-amino-9-methoxy-2,6,8-trim ethyl-10-phenyldeca-4,6-dieno ic acid)是一種特殊的胺基酸,是毒素活性表達所必需基團;R1和R2在不同的微囊藻毒素變體中代表不同的L-胺基酸,並以此為該毒素命名。在已發現的MCs異構體中,最常見且已商業化提取的是MC-LR、MC-YR、MC-RR、MC-LF、MC-LW,L、R、Y、F、W分別代表亮氨酸、精氨酸、酪氨酸、
苯丙氨酸 、
色氨酸 。
化學性質 MC具有水溶性和耐熱性,加熱煮沸都不能將毒素破壞;自來水處理工藝的混凝沉澱、過濾、加氯、氧化、活性炭吸附等也不能將其完全去除。MC易溶於水,甲醇或丙酮,不揮發,抗pH變化。化學性質相當穩定,自然降解過程十分緩慢。MC在去離子水中可保持穩定狀態長達27d,在滅菌的河水中可保持穩定12d,而在普通河水中7d以內即會降解,降解速度在原產地河水中最大,在不同產地的河水中次之,在腐殖化的水中最小(Rapala et al.,1994)。此外,純化的MCs在陽光照射下依然保持其穩定性,但暴露於紫外線時即可被水解或發生化學異構和化學鍵合反應而失活,其半衰期為10d。當紫外線波長接近其吸收峰周圍(即238~254nm)時,MCs可被迅速降解此外由於MC分子結構含有
羧基 、
氨基 和醯氨基,所以在不同pH值下,MC有不同的離子化傾向。
微囊藻毒素標準曲線 在已報導的MC的80多種異構體中,MC-LR是最為常見的種類,且相關的毒理學研究最多,腹腔注射小白鼠的LD50值一般在50-60μg/kg(體重),因此,MC-LR的毒性可與化學類有機磷神經相當。
國內外的微囊藻毒素檢測標準
世界衛生組織 (WHO)推薦的飲水中的藻毒素標準為1.0 ppb。各國已有飲水中的藻毒素含量標準一般都為微囊藻毒素LR的含量,加拿大健康組織規定飲水中可接受的藻毒素標準為0.5 ppb,澳大利亞學者建議1ppb的含量為安全飲用水的上限。中國微囊藻毒素的標準檢測國標主要有:GB/T5750.8-2006、GB/T 20466-2006、GB3838-2002、HJ/T 91-2002。《水中微囊藻毒素的測定》(GB/T 20466-2006)中規定了微囊藻毒素LR、微囊藻毒素RR的測定和微囊藻毒素YR的兩種測定方法;《飲用水的有機標準》(GB/T 5750.8-2006)中規定了微囊藻毒素LR和微囊藻毒素RR的檢測方法;《地表水環境質量標準》(GB3838-2002)中規定了微囊藻毒素LR的標準限值和最低檢出限,分別為1和0.01ppb;《地表水和污水監測技術規範》(HJ/T91-2002)中規定了微囊藻毒素-LR的最低檢出濃度為1ppb,小數點後最多位數為3。
微囊藻毒素異構體 毒理 分子機理 MC主要由微囊藻產生,但並非所有的微囊藻都能產生MC,產生MC的分子機理現已明確,是由一類包含肽類合成酶(peptide synthetase)、聚酮合成酶(polyketide synthases,PKSs)和其他修飾酶在內的巨酶複合體通過非核糖體(nonribosome)途徑合成的。編碼MC合成酶的基因簇已經獲得測序鑑定,這個55kb的基因簇由一混合型非核糖體肽類合成酶(聚酮合成酶性質,mcyA-mcyE和MCyG)的6個開放式閱讀框(ORFs)和4個小型的被認為具有前體和裁剪功能(mcyF 和MCyH-mcyJ)的OPRs 組成。Kaebernick 等研究發現光照影響MC合成酶產量,mcyB和MCyD轉錄水平在強光照條件下有所提升,紅光和藍光以及一些特定的人為應激因素等,如產烷微生物(methylogen)和NaCl的存在能減弱其轉錄水平。因此可認為MC的產生雖然是由基因決定的,但環境條件可以調節和控制基因的表達,從而影響到毒素合成。
微囊藻素與DNA表面分子結合示意圖 遷移轉化 除影響MC產生外,各種環境因子,如光照強度、溫度、水體pH值、營養鹽濃度、溶解氧、色素及其他水生生物等因素都會影響MC在水體中的遷移轉化。純微囊藻毒素在日光照射下是穩定的,但也可被紫外線光解或通過異構化作用喪失毒性,其半衰期約10天,特別是紫外線波長接近其最大吸收波長(238-254nm)時,降解速度大大增加(數分鐘內)。環境水體中色素和腐殖質等光敏劑存在能促進MC的光解作用,這種降解方式可能是某些水體中MC歸宿的主要方式;此外,生物降解也是MC在環境水體中的主要轉化途徑。天然水體中的某些特殊細菌或微型動物水生生物,能通過自身代謝改變MC側鏈Adda 的結構或打開環狀結構降低毒素毒性。MC-LR在去離子水中可保持穩定超過27天,但其在天然水體中不到1個星期即發生初級降解,這是由於生物降解通過Adda 側鏈的修飾而滅活這一機制實現;水中的有機物和溶解氧通過影響水生生物的活性,從而間接控制藻毒素的降解。
毒效應 動物模型實驗表明,MC具有明顯的嗜肝性,其污染與肝癌的發生、肝壞死以及肝內出血有密切關係,嚴重時甚至能引起受試生物死亡。MC跨膜轉運需要ATP 依賴性的轉運蛋白(ATP-dependent transporter)。對大鼠毒理學研究表明,膽汁酸轉運蛋白(bileacid transporter)很可能是MC的轉運載體。而MC的毒性主要限於肝臟,是因為其細胞膜上具有有機陰離子轉運蛋白的器官;隨著有關MC毒性的不斷深入研究,還發現MC具有多器官毒性、遺傳毒性、神經毒性、免疫毒性和潛在的促癌性,並能引起受試生物發育異常。可見MC的毒性效應範圍十分廣泛。
肝毒性 MC是一種肝毒素,這種毒素是肝癌的強烈促癌劑。家畜及野生動物飲用了含藻毒素的水後,會出現腹瀉、乏力、厭食、嘔吐、嗜睡、口眼分泌物增多等症狀,甚至死亡。對於人類健康,微囊藻毒素也具有很大危害性。其中MC-LR的半致死劑量(LD50)約為50μg/kg~100μg/kg。人們在洗澡、游泳及其他水上休閒和運動時,皮膚接觸含藻毒素水體可引起敏感部位(如眼睛)和皮膚過敏;少量喝入可引起急性腸胃炎;長期飲用則可能引發肝癌。
MC對肝細胞影響的特點是細胞凋亡與活躍的細胞增殖相伴隨。MC促肝癌動物模型對MC的促癌作用進行了研究,結果顯示,①MC可顯著增加大鼠肝癌前指標γ-谷氨醯轉肽酶(γ-GT)的陽性率;②MC可上調肝癌前病灶的主要凋亡抑制作用基因bc1-2的表達,同時可下調促細胞凋亡作用基因bax的表達。進一步證明MC有促癌作用,並且初步明確了調節與細胞凋亡相關的癌基因和抑癌基因表達可能是MC促癌過程的重要機制之一。MC作用於肝巨噬細胞,刺激細胞產生白細胞介素1(IL-1),IL-1再誘導產生可以引起急性炎症反應的物質,如前列腺素、血栓素及腫瘤壞死因子-δ(TNF-δ),這些物質導致了肝臟損傷和壞死,並引起炎症休克。此外一些實驗還證實,MC是腫瘤促進劑,對免疫功能產生明顯的抑制作。
微囊藻素毒性作用通道示意圖 肝臟是MC主要的靶器官,急性中毒主要表現為肝臟腫大,淤血,肝體比重增加,肝臟細胞被破壞,肝臟出血壞死。已有研究結果表明,MC是以肝臟為靶器官的多肽毒素,通過對鼠或魚腹腔注射或經口給予毒素染毒,可以使動物在3h內迅速死亡,死亡前動物出現蒼白和虛脫並伴有抽搐,解剖觀察發現肝臟腫大,肝細胞小葉中心性壞死,肝細胞內有大量的紅細胞,而其他部位呈缺血狀態及出血性休克的結果。
微囊藻毒素的氧化脅迫及其影響 光鏡下可見肝竇狀血管破壞、血竇內皮損傷、細胞間隙增大。電鏡下肝細胞超微結構發生改變,粗面內質網發生摺疊、線粒體脊膜擴張、胞質空泡樣變、漿膜反折、細胞內器重新分布,肝細胞壞死融合成帶,出現橋接樣壞死。血清酶學表現為乳酸脫氫酶(LDH)滲漏,γ谷醯基轉移酶(γ-GT)和鹼性磷酯酸合成酶(AKP)升高。細胞超微結構出現異常變化,內質網破碎,發生核糖體的脫粒現象;線粒體內部結構尤其是嵴發生變形、碎裂,出現溶解。內質網碎片包繞線上粒體周圍,細胞內容物稀疏,細胞質結構分布比較隨機,規律性降低等。
腎毒性 有研究表明MCs具有腎毒性,腎臟是微囊藻毒素除肝之外的另一個重要的靶器官。Bhattacharya等給大鼠腹腔注射MCs,發現血中尿素和肌酸水平升高,白蛋白含量下降,隨後尿中出現血紅素、蛋白、膽紅素,而腎臟乳酸脫氫酶及穀草轉氨酶下降,表明MCs具有腎毒性。並且Ito等研究認為,微囊藻毒素會在腎中產生蓄積,所以可能產生的腎毒性更大。研究發現,給小鼠注射亞致死劑量的微囊藻毒素,會使腎小球的毛細血管簇遭到破壞,腎小球、近曲小管和遠曲小管的管腔擴大,並且管腔中有大量的紅細胞,近曲和遠曲小管的上皮細胞脫落到管腔內或消失,許多管狀上皮細胞的細胞質中出現液泡,胞間隙中有淋巴細胞浸潤。用離體腎灌注系統研究表明,微囊藻毒素能夠改變腎的一些功能指標如:灌注壓(PP)、腎血管阻力(RVR)、腎小球濾過率(GFR)等。
微囊藻毒素致人淋巴細胞損傷 生殖毒性 2005年發表的一項研究發現,淡水湖泊中水生無脊椎動物的性腺和卵中積累有大量MC-LR。Liu 等也發現泥鰍胚胎的發育後階段對MC-LR的敏感性大於早期,而幼泥鰍的敏感性遠遠低於胚胎,死亡率及發育畸形率存在劑量-反應關係。張占英等給孕鼠妊娠連續10d腹腔注射MC-LR發現,不同劑量的毒素(4~62μg/kg)均可損傷胎盤屏障,使整個胎盤細胞變性、水腫和間質疏鬆。微囊藻毒素通過胎盤屏障進入胎鼠體內,影響胚胎的形成和發育,導致胎鼠發育畸形或臟器發育不良及損傷,且隨著染毒劑量的增高,畸胎髮生率也隨之增高。不同研究結果有差異可能與染毒劑量的大小、染毒次數、時間的長短、對母體損傷程度以及胚胎所處時期不同有關。此外,研究發現MCs對不同類別浮遊動物的影響因藻類濃度變化而異,對草履蟲的抑制作用不明顯,而對綠眼蟲的生長繁殖抑制較強,甚至無法生存。藻毒素還可在卵中大量存在並傳遞到後代。因此,微囊藻毒素對包括人類在內的哺乳動物生殖的影回響該受到關注和重視。
免疫系統毒性 機體可通過免疫監視來預防或限制腫瘤發生,在遺傳或環境作用下若機體免疫功能低下或缺陷,惡性腫瘤發生率就增高,因而它是與腫瘤形成有關的重要因子。染毒低劑量微囊藻毒素就可導致小鼠免疫抑制。腫瘤壞死因子α是一個內源性的腫瘤促進劑,在腫瘤的促進、演變過程中起著重要作用。在經微囊藻毒素處理的小鼠肝細胞中可見有其基因的表達。不同濃度的MC-LR體外激活巨噬細胞後,ELISA分析發現微囊藻毒素可誘導腫瘤壞死因子-α的合成與釋放。
心臟毒性 微囊藻毒素對於心臟同樣具有毒性作用。在致死劑量的MC-LR作用下,小鼠心臟的心率以及血壓同時急劇下降,心輸出量以及每搏輸出量也呈現持續下降的趨勢,顯示微囊藻毒素對於心臟泵血功能存在損傷作用。發現在微囊藻毒素作用下,鼠心肌細胞結構變得不規則,細胞之間失去相互黏附的能力,在低劑量組,細胞變大,伴隨著擴大且形狀改變的細胞核,偶見細胞質空泡化以及部分肌纖維退化。高劑量組出現無序雜亂的心肌纖維,退化的肌肉纖維並伴有肌細胞的溶解。同時,血管畸形以及輕微的
淋巴細胞 滲入,線粒體的病理改變也在心肌細胞中發現。心肌細胞的功能障礙還可能與細胞骨架的改變有所聯繫,同時心肌富含線粒體,線上粒體和質膜中富含多不飽和脂肪酸,所以心肌很容易受到微囊藻毒素毒性作用所產生的自由基攻擊的影響。在微囊藻毒素暴露下引起的心臟的病理改變造成了心肌功能受損,進而引發循環系統的紊亂和循環系統能力的不足。
致癌機理 腫瘤發生過程一般包括啟動、促進和形成三個階段。研究發現,MCs引起細胞蛋白質磷酸化(去磷酸化)平衡的改變是其促進腫瘤形成的決定性因素。細胞蛋白磷酸化(去磷酸化)平衡是細胞信號轉導的調節樞紐,該平衡協調和控制著細胞內多種生化反應過程,如生長、分裂、增殖和細胞形態維持等。MCs抑制細胞內蛋白磷酸酶的活性,打破了細胞內蛋白激酶和
蛋白磷酸酶 之間的相對活力平衡,導致蛋白激酶和蛋白磷酸酶的無序調節,引發蛋白質的過磷酸化,導致細胞生理生化代謝紊亂,最終促進腫瘤的形成。
微囊藻素染毒劑量對細胞亞蛋白影響 人類細胞中普遍存在癌基因和抑癌基因,在正常情況下,這兩類基因是人類細胞生長所必需的,當它們在體內的活性發生改變時,可導致正常細胞惡性轉化,引起腫瘤的發生。MCs強烈抑制PPl和PP2A的活性,導致細胞內多種蛋白質過磷酸化,使細胞內蛋白質磷酸化(去磷酸化)調節失衡,並通過細胞信號系統改變多種酶的活性,繼而影響與細胞生長有關的基因表達。大量研究表明,隨著MCs暴露時間及濃度的不同,可引發不同癌基因和抑癌基因的表達發生變化。
毒代動力學 蛋白磷酸酶抑制途徑 MC對真核生物最為重要的分子致毒機理是其能強烈並特異性地抑制絲氨酸和蘇氨酸蛋白磷酯酸合成酶1 和2A(PP1 和PP2A)的活性,而蛋白磷酸酶PP1和PP2A參與許多重要的胞內過程,如細胞生長、分化、蛋白質合成、細胞信號傳導等,研究證實,MC和PP1和PP2A之間是一種不可逆的共價結合。磷酸酶受抑制的結果影響了細胞內蛋白磷酸化和去磷酸化的平衡,相應地增加了蛋白激酶的活性,或導致細胞內多種蛋白質的過磷酸化,由於細胞骨架蛋白的過磷酸化,誘導了細胞中間纖絲網路的重排,引起了細胞骨架系統結構的破壞,造成細胞膜泡樣變、膜完整性喪失、凋亡以及細胞壞死等效應。
損傷遺傳物質 DNA的支架系由脫氧核糖經磷酸二酯鍵連線起來,外原化合物可通過攻擊脫氧核糖或磷酸二酯鍵而導致DNA鏈的斷裂。10~100μg/ml劑量的MCs引起HL60細胞明顯的DNA鏈斷裂,染毒量與DNA鏈斷裂之間呈現劑量-反應關係,相同劑量的MCs還引起HL60細胞微核率升高,隨著染毒劑量的增加,微核率呈增高趨勢。化學毒物引起DNA鏈斷裂在其遺傳毒性及致癌性中起重要作用,致癌作用是DNA上損害的主要和長期後果。
微囊藻毒素對細胞亞基蛋白影響 許多環境致突變物和致癌物可在生物體內直接或間接與DNA發生共價結合而形成外源性DNA加合物。比如8-羥基脫氧鳥嘌呤核苷(8-OHdG),8-OHdG是一種錯配修飾鹼基。體外實驗發現,MCs能引起8-OHdG水平增高,且處理劑量與8-OHdG水平成劑量-反應關係。DNA加合物形成可干擾DNA合成過程中的鹼基配對錯誤複製和損傷的修復障礙,進而影響細胞的分裂。
DPC是DNA與蛋白質形成的穩定的共價化合物,作為外來化學物的毒作用分子生物標誌已受到關注。如果機體內的大分子物質受到外來理化因素的作用,則可以誘導出超量的DPC,而超量的DPC是一種病理狀態,可影響基因的表達,破壞染色體結構。因此,DPC作為遺傳毒性的生物標誌物有非常重要的價值。MCs能誘導小鼠肝、腎、睪丸細胞DPC的形成,從而造成了對小鼠DNA的損傷。與其它類型的DNA損傷相比,DPC較難修復,在細胞周期中持續時間較長,當DNA複製時,易造成一些重要基因(如抑癌基因)的丟失,並有可能導致腫瘤或某些嚴重疾病的發生。
活性氧途徑 研究表明,MC除了抑制磷酸酶致毒外,氧化應激以及線粒體通透性轉換在MC致毒機理中也起著很重要的作用。MC可以誘導細胞內活性氧(ROS)產生,導致細胞損傷和脂質過氧化,並有可能通過某些通路誘導細胞凋亡,MC的肝臟毒性部分也是由於誘導活性氧(ROS)的產生。體內和體外的實驗也表明,MC引起受試生物的某些DNA損傷也很可能是由活性氧介導的。雖然研究表明MC能導致各種類型的細胞脂質過氧化從而引起氧化損傷作用,但是還應看到,在MC如何引起ROS含量升高及其在誘導的細胞毒性中機理方面的研究還有待深入。有研究表明,藍藻毒素如MC誘導ROS產生可能類似於缺血-再灌注過程刺激ROS產生的機制;體外試驗則表明ROS產生也是魚肝細胞和淋巴細胞對於MC暴露的一種代謝回響。MC暴露使ROS過量產生,引起的氧化應激改變胞內GSH含量和其他含巰基類物質,誘導線粒體膜通透性轉變孔開放從而導致線粒體膜電勢去極化和線粒體通透性轉換,並進一步導致細胞色素c釋放以及產生凋亡信號等一系列細胞事件發生。一些能增強機體抗氧化能力的藥物,如N-乙醯半胱氨酸(NAC)和萊菔硫烷(SFN)的預處理,可顯著減輕MC的細胞毒性,表明了氧化應激在MC生物致毒機理中的關鍵作用。
其他途徑 ATP合成酶β-亞基(ATP-synthasebetasubunit)已被證明是細胞內能夠進一步結合MC-LR的受體,而此加合物很有可能在高MC-LR濃度脅迫下通過擾亂線粒體功能(如釋放細胞色素c)引發細胞凋亡信號,雖然ATP合成酶β-亞基能和MC形成加合物,但毫無疑問磷酸酶仍是細胞內和MC最重要的結合物。另外,MC-LR誘導細胞色素釋放,並可以激活鈣蛋白酶,但對於鈣蛋白酶是否參與MC誘導的凋亡過程並不清楚。
水生生物生態毒理學 水生植物生態毒理學 微囊藻毒素是一種具有自我強化機製作用的生態生長調節素,高濃度MC可以影響水生植物種類的多樣性,從而幫助藍藻獲得競爭優勢,直至形成水華。水生植物則直接受到水體中的MC影響,並可能通過他感作用(allelopathy)與產生毒素的藻類發生相互作用。在MC對植物的毒性作用機制中,磷酸酶抑制途徑可能並不重要,而ROS的誘導升高可能是其最主要的致毒機理。經MC-RR處理後,細長聚球藻(Synechococcus elongatus)的生長明顯受到抑制,ROS水平升高引發氧化脅迫,導致丙二醛(MDA)含量顯著升高。MC-LR誘導甲藻(Peridinium gatunense)產生的氧化應激與MAPKs旁路關鍵酶的激活有著密切關係。
研究證實金魚藻(Ceratophyllum dermesum)能夠吸收水中的MC-LR,誘導植株ROS水平升高;微粒體和谷胱甘肽硫轉移酶(GST)活性升高,表征MC-LR在植物體內參與了生物轉化,與GSH結合形成共軛產物,使GSH含量下降。抗氧化系統中還原性谷胱甘肽(GSH)是抵抗細胞成分免受RO傷害的重要物質,研究表明GSH結合MC形成的共軛產物是生物對MC解毒進程的第一步。通過HPLC-MALDI-TOF檢測出了金魚藻體內的MC-LR-GSH(m/z 1302. 79),直接證實了植物體記憶體在著這一MC解毒過程;MC-LR的脅迫還能抑制金魚藻生長、降低光合作用產氧量以及改變金魚藻色素表達模式。
Keating(1978)最早在Science上報導了微囊藻的提取物可抑制硅藻的生長,並推測可能是其中的毒素起作用。Singh 等(2001)研究認為,MCs有抗藻效應。高濃度的MC-LR(25、50μg·mL-1)短期暴露後,可抑制灰色念珠藻(Nostoc muscorum)和魚腥藻(Anabaena BT1)的生長,並降低O2釋放、葉綠素a 含量和固氮酶的活性,研究結果提示,MCs可能能夠抑制藻類的光合作用,進而由於ATP 和還原劑的減少影響到固氮作用,最終使藻的增殖受到抑制。然而,進一步研究發現,MCs對其它水華藻類的作用則表現為抑制或殺死競爭者(細長聚球藻Synechococcus elongatus、水華束絲藻Aphanizomenonflos-aquae),促進後續藻類(蛋白核小球藻Chlorella pyrenoidosa、斜生柵藻Scenedesmus obliquus)的生長。這說明MCs的產生不僅僅是對浮游植物產生簡單的抑制效應,其更重要的生態學意義可能在於調控(抑制或促進)藻類增殖,使產MCs的藻類在水環境中具有競爭優勢。
魚類生態毒理學 已有大量關於MC對魚類產生毒害的文獻報導,如MC處理可以導致魚類肝、腎、鰓、血液循環系統、消化器官、免疫系統等產生損害,並進一步導致魚類產生一系列行為學改變。具體表現為集群活動減少、遊動遲緩,常停留在靠近水面的地方。斑馬魚的白晝活動會隨MCs暴露劑量的增大而先增加後減少。當斑馬魚和小赤梢魚(Leucaspius delineatus)同時暴露在MC-LR低濃度組(0.5μg/L)時,兩種魚的白晝活動明顯增加,暴露在MC-LR高濃度組(50μg/L)時白晝活動都明顯降低;然而兩種魚的遊動時間卻有差異,小赤梢魚在夜間的遊動時間增加,而斑馬魚在白天遊動的多。
水華藍藻對養殖魚類生長和消化酶活性也有顯著的影響。急性毒性結果顯示,魚類對MC-LR的耐性遠強於小白鼠。水生生物耐性高的原因還沒有確切的定論,可能是其比哺乳動物更多的暴露於含MC的水環境中,長期進化導致MC在魚體中的清除速率要比哺乳動物快得多。
急性毒性實驗表明,對鱅魚腹腔注射MC粗提液,肝臟的病理狀況在注射後24h 內隨著時間增長而加重,同時發現肝細胞在低濃度MC作用下主要以細胞凋亡的形式死亡,而高濃度MC作用下主要以細胞壞死的形式死亡;此外,MC導致肝臟早期超微結構的變化是使細胞間隙增寬,注射後48h,肝組織有所恢復,組織損傷相對毒素的累積具滯後性。對鰱魚的急性毒理實驗也能觀察到類似的結果。此外,暴露於MC的魚體內能誘導抗氧化系統回響和血清生化指標變化。
魚類通過鰓與水體交換氧氣和二氧化碳進行呼吸作用,研究發現MC暴露能造成鯉魚鰓上皮細胞衰退和鰓小塊組織壞死,甚至對鯉魚腹腔注射MC也能發現這種症狀;MC-LR還能直接抑制鰓細胞的離子泵,已發現MC-LR(2和20μg·L-1)的慢性暴露30d 顯著增加了斑馬魚(Danio rerio)肝內毒素的累積和磷酸酶活性,但PP2A豐度卻沒有顯著性變化。此外,處理組的肝細胞粗面內質網和線粒體腫脹,細胞核核仁出現蜂窩狀結構。和對照組相比,處理組22個蛋白的豐度出現了顯著的改變。經鑑定這些蛋白分別與細胞骨架裝配、大分子代謝、氧化應激和信號傳導有關,表明MC-LR對魚類肝臟毒性是複雜多樣化的,因此慢性脅迫下的氧化損傷可能是更為主要的致毒途徑而不是磷酸酶抑制途徑。慢性暴露下水體中低濃度的MC-LR就可以顯著影響細胞進程,因此在制定水體MC-LR基準必須予以更多關注。
2009年7 月的原位研究發現,雖然太湖梅梁灣水域水體MC含量並未超標,但置於藍藻水華中的鯉魚由於攝食有毒藍藻,體內毒素含量(其中肝臟>腸道>鰓>肌肉)和肝臟ROS顯著高於室內對照與胥口灣水域的樣品,與此對應的,梅梁灣水域的鯉魚肝臟MDA 和蛋白羰基含量也顯著高於對照組,顯示魚體已經受到氧化損傷,其程度與ROS水平顯著相關。此外,抗氧化系統指標GSH/GSSG比值變化很好地對應了各原位點的藍藻水華污染程度,並與藻密度大小顯著相關。
毒素檢測 用於檢測微囊藻毒素的方法有很多,例如生物分析法、細胞毒性檢測法、酶聯免疫吸附法(ELISA)、
高效液相色譜法 (HPLC)、
毛細管電泳法 (CE)、蛋白磷酸酶抑制法等,這些方法都有各自的優點,但又有不同程度的缺陷性.生物檢測法不能區分微囊藻毒素的異構體,工作量很大;細胞毒素檢測法的靈敏度較低;高效液相色譜法的預處理過程繁瑣,設備昂貴;CE法的重現性差;蛋白磷酸酶抑制法不能區分特異的毒素同系物,且後處理困難。
生物分析法 動物試驗法是最早採用的常規毒性分析法,主要是採取對小鼠進行灌餵或腹腔注射來鑑定藻毒素的毒性。該方法能直觀地反映微囊藻毒素的總體毒性。用純化的MCs或藍藻中粗提取的藻毒素進行測試,根據半致死劑量(LD50μg/kg)可初步確定其毒性。除個別異構體的LD50為200~250μg/kg,多數MCs的LD50為60~70μg/kg。該法具有操作簡單,結果直觀、快速等優點,但需要消耗較多的毒素,靈敏度和專一性都不高;無法準確定量,也不能辨別毒素的異構體類型;小鼠的維持費用高、工作量大。因此,動物試驗法通常只作為毒性檢測的最初篩選方法,並且正日益被其他方法所取代。
細胞毒性檢測技術是利用毒素對細胞的毒性作用來檢測毒素的一種技術,不僅可以判斷毒素是否存在,還可以對毒素進行精確的定量。谷康定等用2步灌流法製備大鼠原代肝細胞,經MC-LR處理後,數小時後細胞形態學即發生改變,其靈敏度可達μg/L級。Fladmark等利用藻毒素誘導沙門氏菌和大鼠的原發性肝細胞死亡的能力為參數檢測MC-LR,表明懸浮培養液中的沙門氏菌肝細胞為檢測較廣範圍的肝毒素提供了迅速靈敏的系統。該技術靈敏度雖然較高,但操作繁瑣,基本上處於初步研究階段,較難得到推廣套用。
物化分析方法 高效液相色譜法(HPLC)是最常用的MC分析方法之一。自然界中MC常以痕量形式存在且干擾物質較多,所以色譜檢測前必須先將樣品通過萃取、吸附、富集等預處理,淨化洗脫,再將洗脫液進行HPLC色譜分析,經檢測器檢測,將樣品色譜圖的保留時間和峰面積與標準品比較,從而進行定性和定量。HPLC檢測MC主要使用的檢測器有紫外(UV或VWD)、螢光(FL)、化學發光(CL)、二極體陣列(PDA 或DAD)等,最常用的是紫外和二極體陣列檢測器。MC是一種環狀多肽,其共軛雙鍵在237 nm~239 nm下有最大吸收,故可通過紫外檢測。紫外檢測器成本較低,但MC各種異構體之間的特徵吸收很接近,也就是說,紫外檢測器在識別MC過程中存在相互干擾的缺陷,影響測定準確度;另外如果有其他物質伴隨MC一同洗脫出來,其單波長吸收峰就會受到干擾。二極體陣列檢測器比單波長紫外檢測器解析度高(它有一個特定的光譜吸收範圍,通常是190 nm~280nm),噪音低,線性範圍寬,其缺點是流動相的選擇有一定限制,流動相的截止波長必須小於檢測波長。
微囊藻毒素色譜 HPLC可以對MC進行定性和定量,是了解MC化學性質甚至結構的重要手段,但是它對高純度標準品高度依賴,而由於技術的限制,商業用標準品又非常有限,這就限制了HPLC測定MC的發展。
液質聯用法(LC-MS)以液相色譜為分離系統,質譜為檢測系統。MC樣品在質譜部分和流動相分離,被離子化後,經質譜的質量分析器將離子碎片按質量數分開,經檢測器得到質譜圖。所以只要知道相對分子質量,就可以對樣品進行精確的定量檢測。1990年,LC/MS 技術首次被套用於藍藻毒素的檢測。
HPLC-電噴霧電離質譜法(HPLC-ESI-MS)是帶有電噴霧離子化系統的質譜分析法。其大致原理是MC樣品溶液在強電場的作用下破碎成許多細小的帶有電荷的液滴,解吸出離子,離子碰撞活化裂解成碎片,從而獲得分子的結構信息,樣品的分子離子和裂片離子經一系列分離器和靜電透鏡進入質量分析器進行質譜分析。1993年開始使用此方法檢測MC。
四極桿質譜由四根帶有直流電壓(DC)和疊加的射頻電壓(RF)的準確平行桿構成,相對的一對電極是等電位的,兩對電極之間電位相反。當一組質荷比不同的離子進入由DC和RF組成的電場時,只有滿足特定條件的離子穩定振盪通過四極桿,到達監測器而被檢測。通過掃RF場可以獲得質譜圖。四極桿成本低,價格便宜,雖然日常分析的質荷比的範圍只能達到3000,但由於分析器內部可容許較高壓力,很適合在大氣壓條件下產生離子的ESI離子化方式,並且,ESI電離最突出特點是產生多電荷,MC電噴霧電離所產生的電荷分布在3000以下,所以四極桿廣泛地與ESI聯用,另外,三重四極桿由於可以做多級質譜,檢出定量限(LOQ)為10pg,滿足了低含量MC樣品的檢測要求。
離子肼質譜是利用離子肼作為分析器的質譜方法。離子肼(Ion trap)由一對環形電極和兩個呈雙曲面形的端蓋電極組成。在環形電極上加射頻電壓或再加直流電壓,上下兩個端蓋電極接地。逐漸增大射頻電壓的最高值,離子進入不穩定區,由端蓋極上的小孔排出。因此,當射頻電壓的最高值逐漸增高時,質荷比從小到大的離子逐次排除並被記錄而獲得質譜圖。離子肼質譜可以很方便的進行多級質譜分析,對於物質結構的鑑定非常有用。Zweigenbaum JA等人採用離子肼質譜對MC-LR、RR等進行質譜碎裂機理的研究,採用LC 柱富集技術,經切換閥將MC通入質譜,最後採用多級離子肼質譜對其母離子和碎片離子進行碎片斷裂分析。
微囊藻素質譜圖冊參考資料。
飛行時間質譜根據相同能量的離子質量不同時速度不同的原理,使用電子電離源,施加脈衝拉出電壓,再經加速極加快離子速度後進入無場區漂移管。不同質量的離子則以不同的時間通過相同的漂移距離到達接收器。飛行時間質譜掃描速度快,靈敏度高,此設備結構簡單,不受質量範圍限制。Pasquale Ferranti等首次運用高效液相/電噴霧-四極桿飛行時間串聯質譜法(HPLC/ESI-Q-TOF-MS/MS)測定淡水中的MC-RR、-LR、-YR、-LW和-LF,其檢出定量限(LOQ)均達到0.1μg/L。使用基質輔助雷射解吸電離飛行時間串聯質譜法(MALDI-TOF-MS/MS)和離子肼串聯質譜法(Ion trap-MS/MS)同時檢測從而比較檢測結果,結果證明HPLC/ESI-Q-TOF-MS/MS檢測淡水中MC具有更高的靈敏度、選擇性和重複性。
微囊藻素異構體HPLC-MS圖 超高效液相色譜是分離科學中的一個全新類別,UPLC藉助於HPLC的理論及原理,涵蓋了小顆粒填料、非常低系統體積及快速檢測手段等全新技術,增加了分析的通量、靈敏度及色譜峰容量。與傳統的HPLC相比,UPLC的速度、靈敏度及分離度分別是HPLC的9倍、3倍及1.7倍。Jing Wang等運用超高效液相色譜串聯質譜法(UPLC-MS/MS)檢測浙江省地表水中的MC-LR、-RR、-LW和-LF,回收率為91.7%~111%,RSD7.9% ~12%,檢出定量限(LOQ)為2.5ng/L,6.0 ng/L,2.5ng/L和1.3ng/L。傳統的液相色譜分離這四種MC需要30min,而UPLC只需要3min;Stuart A.Oehrle等運用UPLC-MS/MS檢測淡水中的7種MC也只用了8 min,其HPLC檢測需要35 min。
免疫化學法 利用微囊藻毒素誘發免疫反應產生抗體,利用抗體對抗原的特異性識別來對各種毒素進行檢測。以免疫技術為基礎,微囊藻毒素的免疫化學法包括酶聯免疫吸附法、放射免疫分析法、免疫親和色譜法、膠體金法及免疫感測器法等。這類方法靈敏度較高、樣品處理簡單,便於操作,其檢測限低於WHO水平,被認為是較有發展前景的方法。
自20世紀80年代末Kifir、Brooks等分別報導了對藻類毒素的單克隆抗體和多克隆抗體以後,酶聯免疫吸附技術(ELISA)開始用於MCs的分析。該技術具有較高的靈敏度、快捷的分析速度等優點。直接競爭ELISA方法其原理是將抗藻毒素抗體包被在多孔板上,被檢樣品、MC-LR標準品與標記有過氧化物酶的MC-LR競爭性結合多孔板上的抗體,過氧化物酶催化底物產生的顏色與MC-LR的濃度成反比,即深色表明MC-LR濃度低,淺色表示MC-LR濃度高。也有將MC-LR牛血清白蛋白包被在多孔板上,利用第一抗體和帶標記的抗體而建立的間接競爭ELISA方法。間接競爭ELISA比直接競爭ELISA方法靈敏度略高。
蛋白磷酸酶法可以反映各種毒素的總量,具有檢測靈敏度高、測定時間較短等優點。Serres等讓未標記的被測毒素和經放射性標記的MC-YR一起與蛋白磷酸脂酶2A(PP2A)進行競爭結合,達到平衡後進行凝膠過濾,使與PP2A結合的毒素和未與PP2A結合的毒素分離,然後檢測收集到的待測125I-MC-YR-PP2A的放射性。根據用B/(Bo-B)(Bo為無毒素時125I-MC-YR的放射性,B為有標準毒素或待測毒素時125I-MC-YR的放射性)和標準毒素的濃度得到的標準曲線即可求出待測毒素的量。Wong等探索了利用比色法篩選水體中的MCs,試驗中以P-硝基苯酚為底物,監測黃色產物P-硝基酚的生成速率以表示蛋白磷酸酶2A的活性。結果表明,比色法蛋白磷酸酶抑制分析是一種簡便、便宜的篩選水體中具有腫瘤促進特性的MCs的工具。
去除技術 生物法 生物方法是一種清潔環保的處理方法,利用生物降解轉化微囊藻毒素已經成為去除微囊藻毒素的主要途徑之一。微囊藻毒素降解的主要突破點在微囊藻毒素分子結構中不穩定基團ADDA,這個基團上的雙鍵容易被一些微生物降解而將毒性去除。自然界中存在這類微生物,但自然降解過程十分緩慢。將這類微生物從自然界中提取出來為微囊藻毒素的生物去除提供了條件。
自1994年Jone等首次從水體中提取出藻毒素的降解菌後,關於藻毒素高效菌種和降解機理的研究就成為國內外專家的研究熱點。Park等從富營養化水體中提取出10支菌株,通過培養和降解試驗後發現,其中1株革蘭氏陰性厭氧菌對MC-LR和MC-RR有著良好的去除效果,3d降解率分別為5.4%和10.2%。Cousins等的研究表明,MC-LR的ADDA側鏈的共軛雙鍵是生物降解的攻擊靶位,正是由於這個結構的變化才導致MC-LR毒性的降低或喪失。
臭氧降解微囊藻素 高級氧化技術 氧化技術(AOTs)是利用反應中產生的強氧化性自由基,使水體中有機污染物分解成小分子物質,甚至礦化成CO2、H2O和相應的無機離子,使污染物得到徹底地去除。該技術利用的強氧化性自由基一般是·OH,比如Fenton體系、濕式氧化技術、臭氧氧化技術、光催化氧化技術、超臨界技術、超聲以及微波技術。
採用Fenton和Photo-Fenton法可以很好地降解MC。Fenton試劑在酸性條件(pH值為2~5)下,產生高濃度的·OH,能迅速攻擊微囊藻毒素(主要是LR型)側鏈ADDA基團的共軛雙鍵,使其改變構型或斷裂,因此去除微囊藻毒素的速率很快。ADDA基團的微小變化將導致微囊藻毒素毒性的降低或脫除Gajdek等初步證實了Fenton試劑對MC-LR的分解能力,採用較低濃度的Fenton試劑進行氧化分解反應,5min後MC-LR的分解率就達97%,30 min後基本上完全分解。
O3作為一種強氧化劑被廣泛套用於飲用水處理中,它可以通過與有機物分子結構中雙鍵迅速發生氧化反應生成羰基化合物。微囊藻毒素結構中的AD-DA上的雙鍵與臭氧作用,被氧化打開而使其毒性消失。Rositano等研究發現,O3對微囊藻毒素有較好的去除效果,其破壞作用強於Cl2等其它化學氧化劑,在與水接觸5 min、水中殘餘O3質量濃度為0.5mg·L-1的條件下,微囊藻毒素的去除率可達100%。最重要的是O3直接作用於雙鍵上,而不會引起藻細胞的裂解。
超音波技術是一項新型的環境友好技術,便於控制與操作。研究表明,超聲輻照是一種降解微囊藻毒素的有效方法,微囊藻毒素在超聲場中迅速被分解去除,降解過程屬於一級反應。且隨著功率的增大,超音波對微囊藻毒素的降解效果增強,20 kHz、120條件下超聲作用5 min時,微囊藻毒素的去除率就達到60%以上,但超音波功率增大到一定程度後降解效果難以繼續提高。
 藍藻系統發育樹
藍藻系統發育樹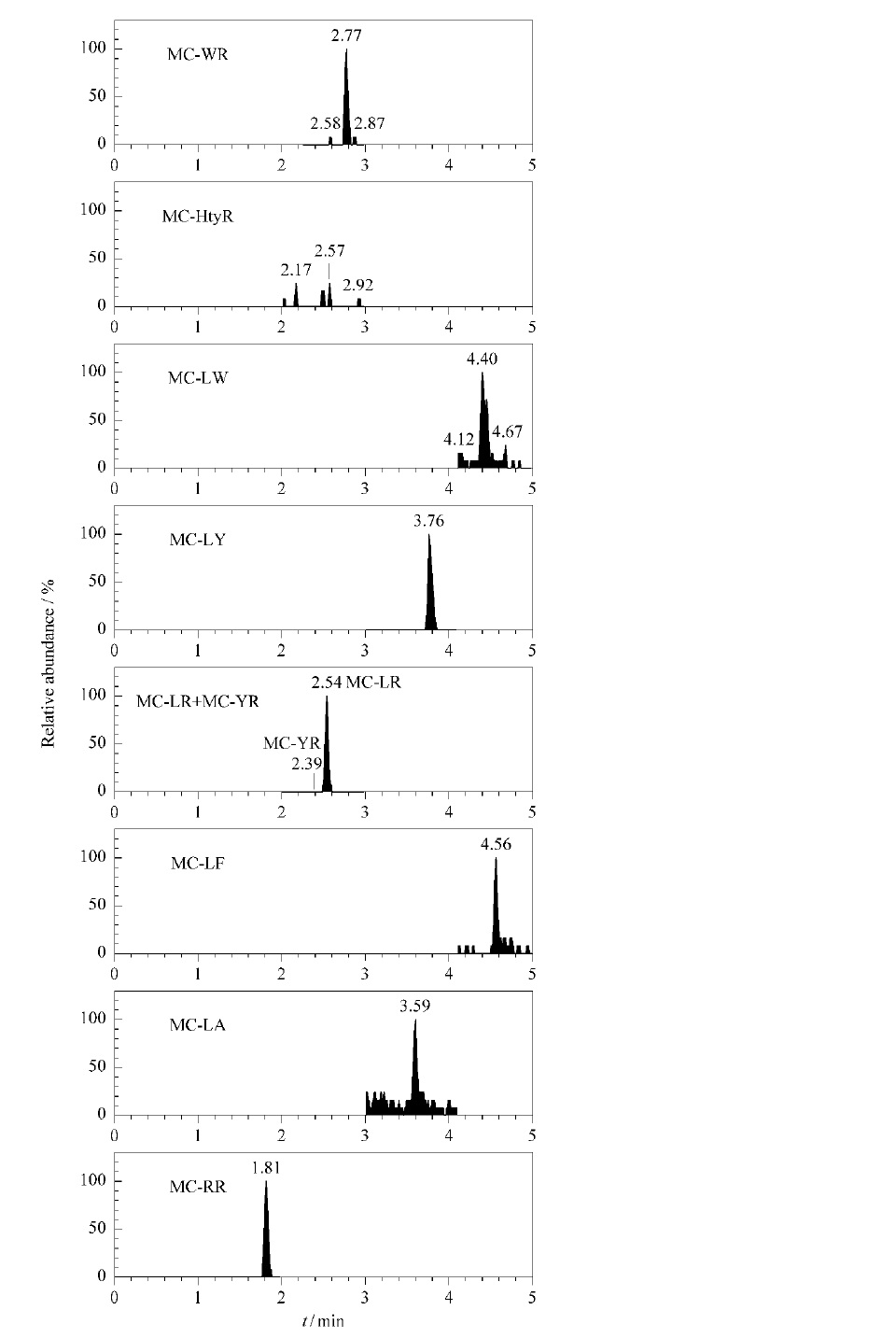 杭州市某水庫質譜測定
杭州市某水庫質譜測定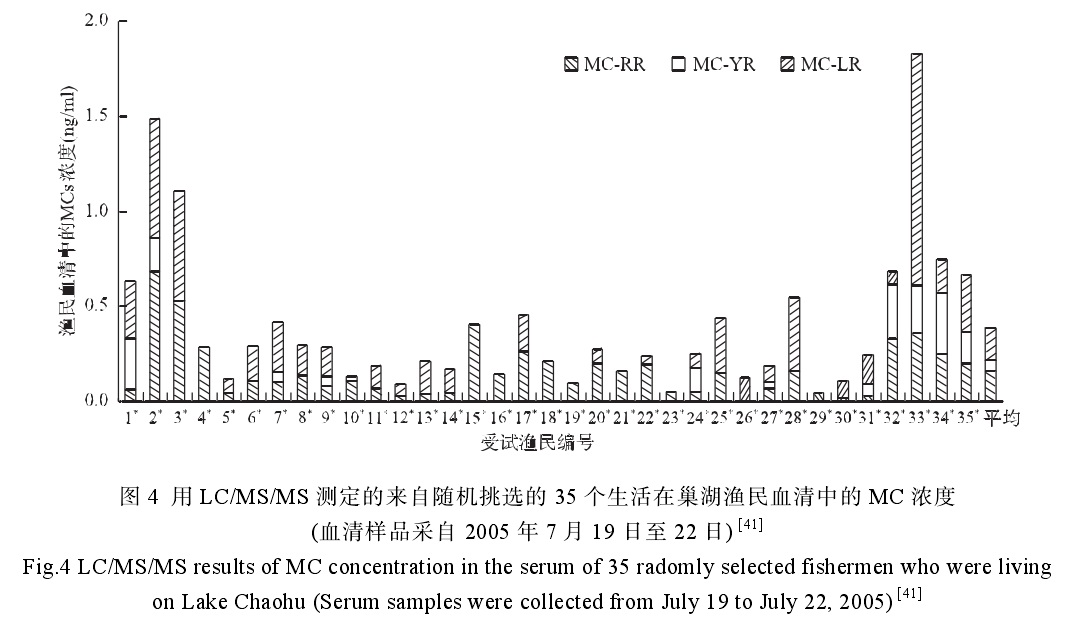 巢湖漁民隨機微囊藻素身體測試
巢湖漁民隨機微囊藻素身體測試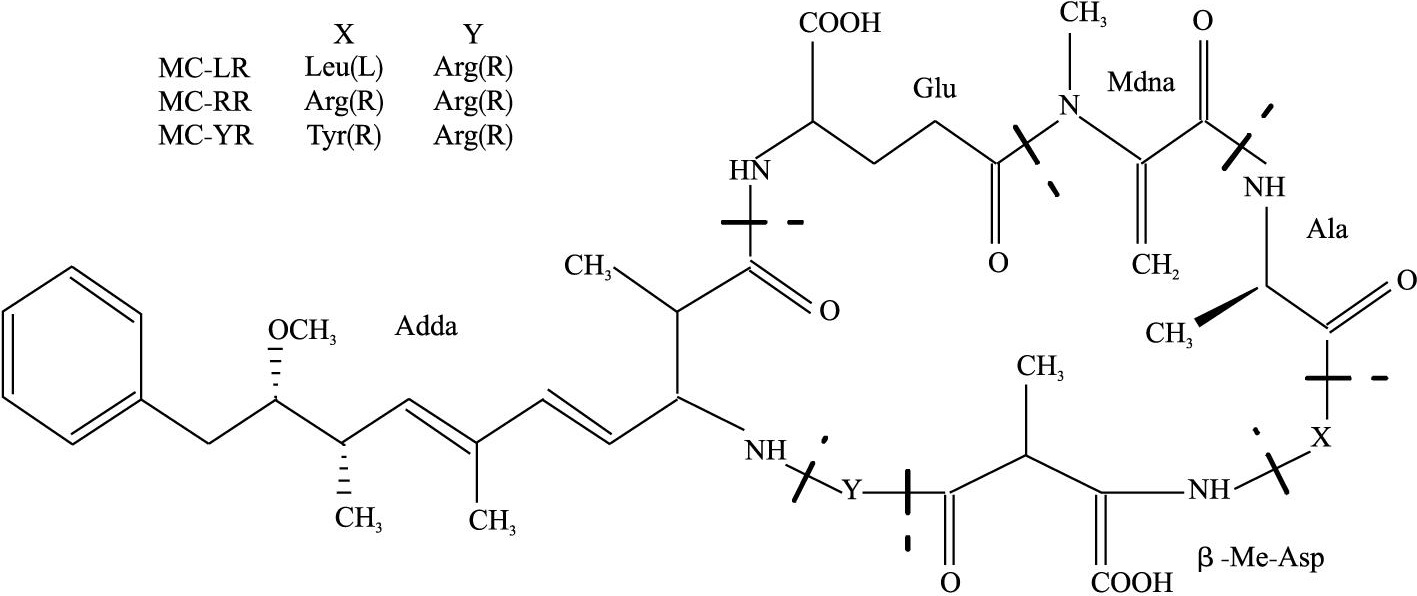 微囊藻素分子結構
微囊藻素分子結構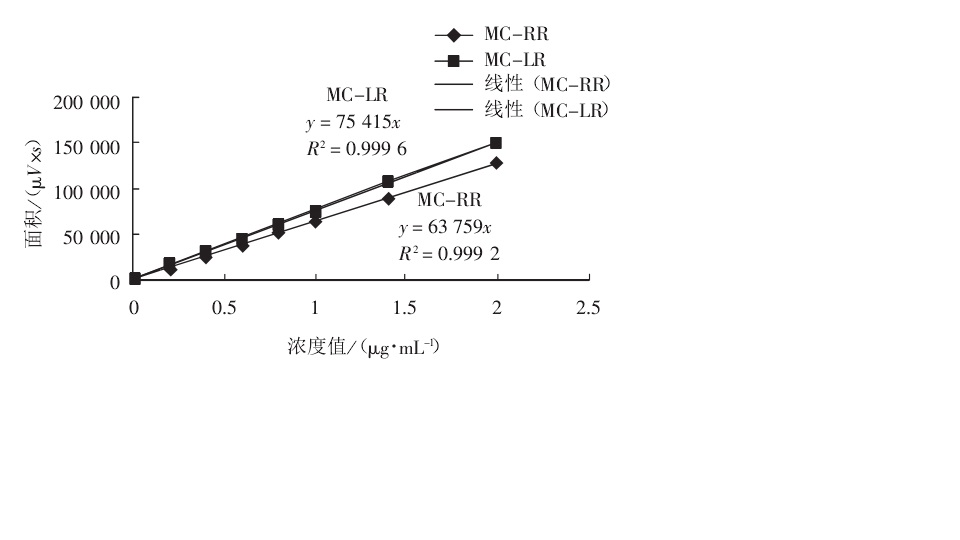 微囊藻毒素標準曲線
微囊藻毒素標準曲線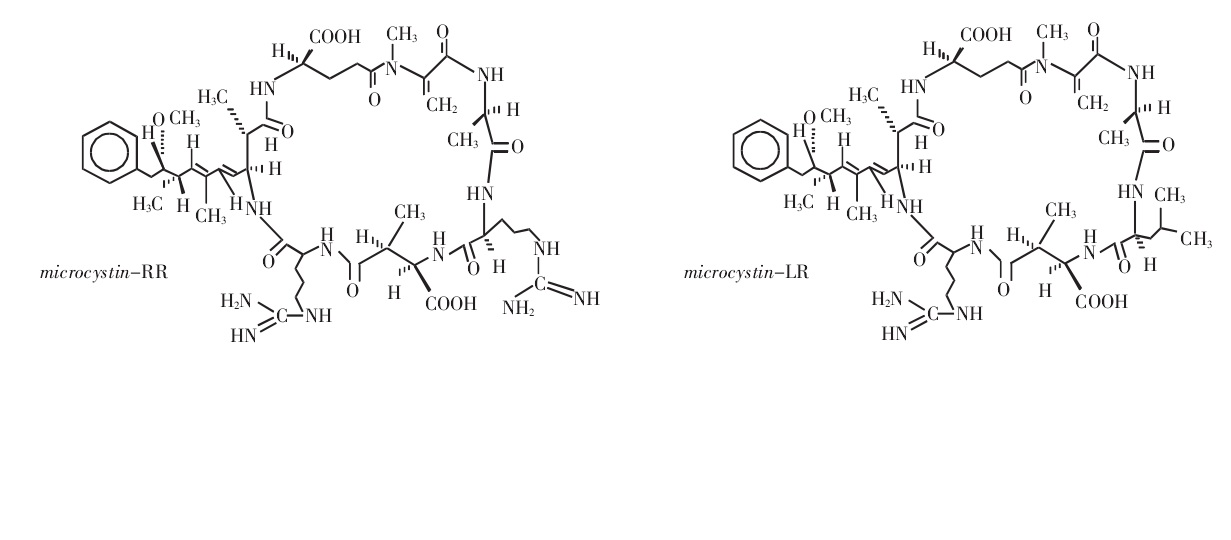 微囊藻毒素異構體
微囊藻毒素異構體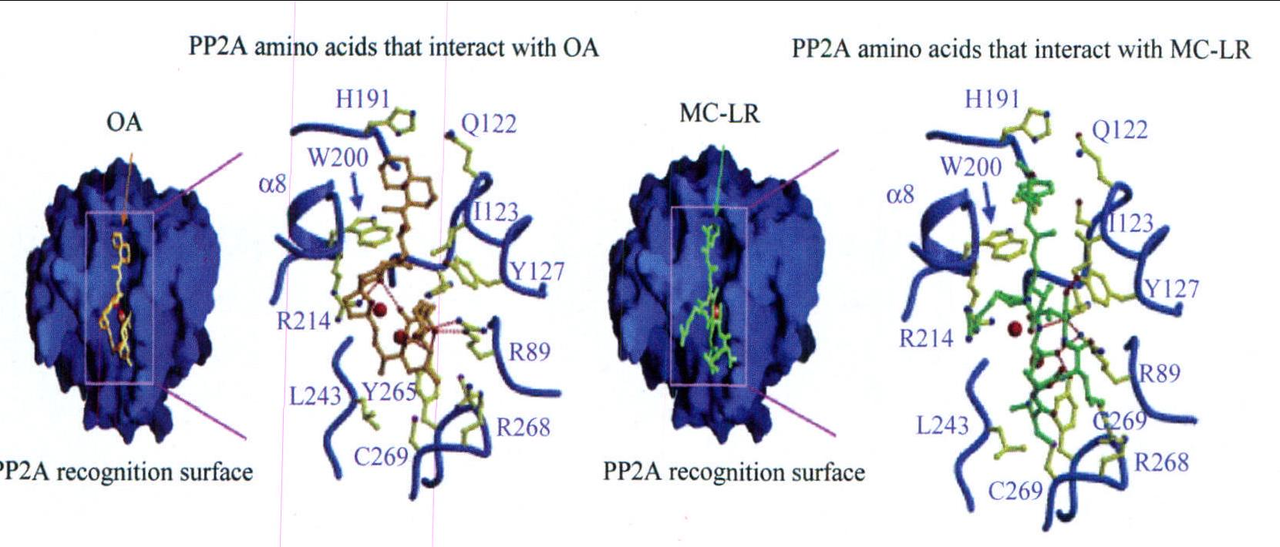 微囊藻素與DNA表面分子結合示意圖
微囊藻素與DNA表面分子結合示意圖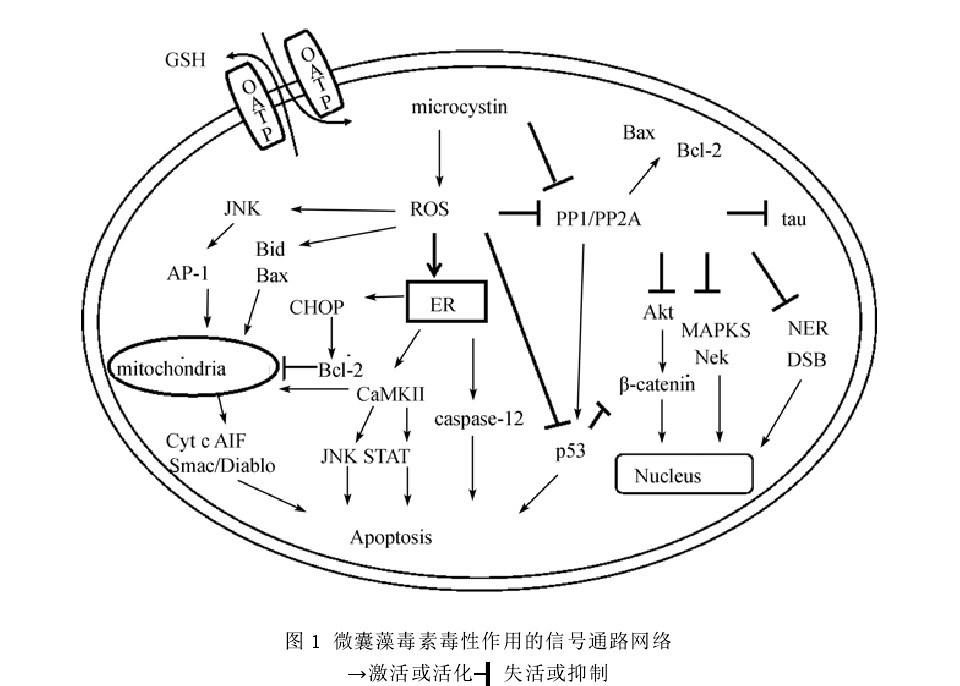 微囊藻素毒性作用通道示意圖
微囊藻素毒性作用通道示意圖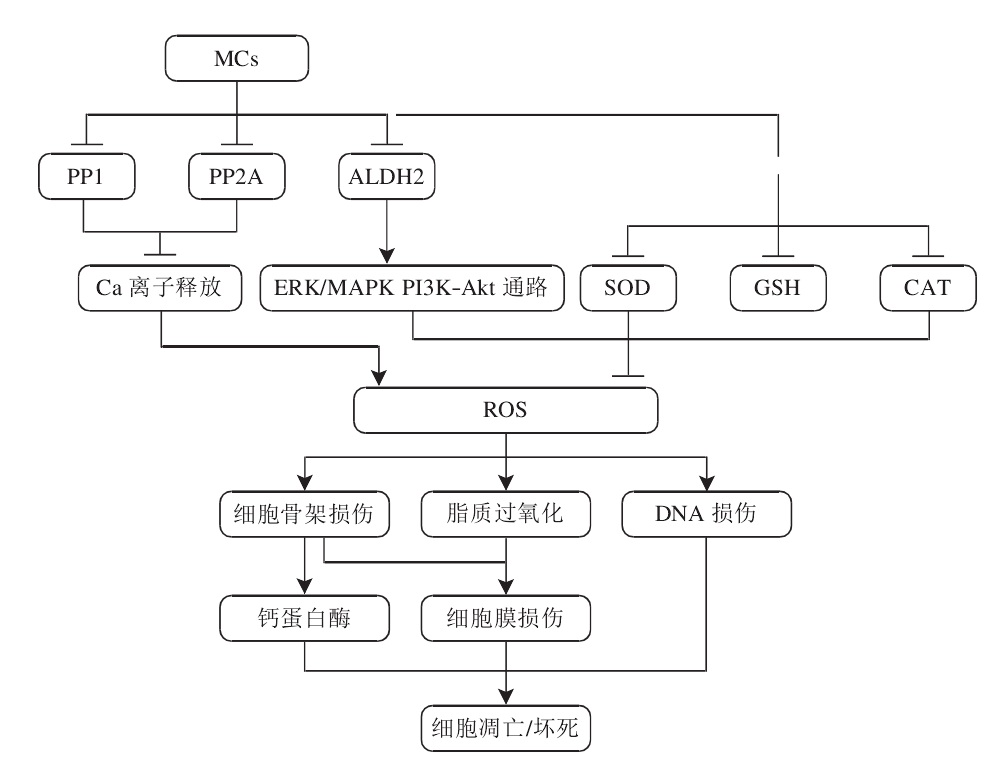 微囊藻毒素的氧化脅迫及其影響
微囊藻毒素的氧化脅迫及其影響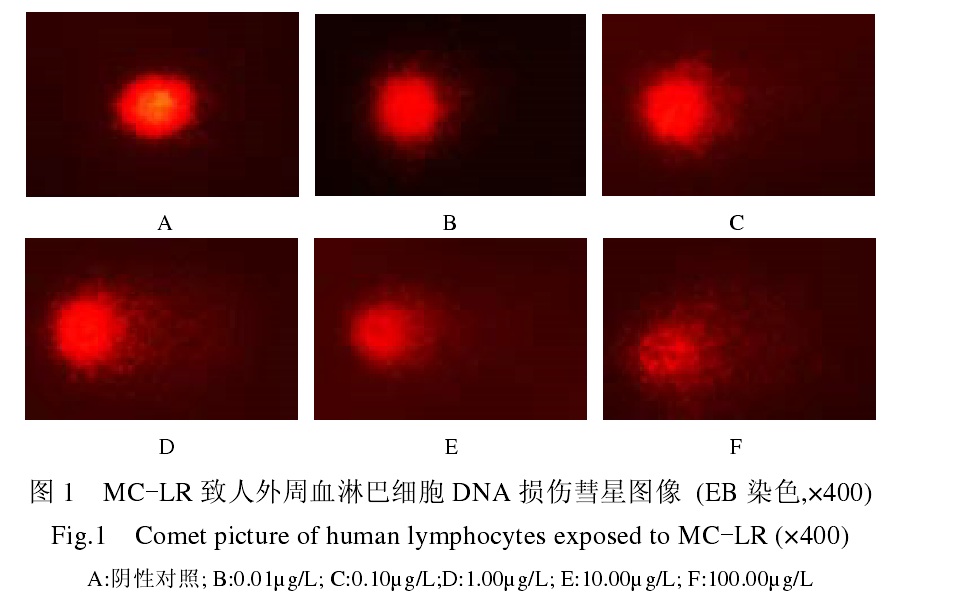 微囊藻毒素致人淋巴細胞損傷
微囊藻毒素致人淋巴細胞損傷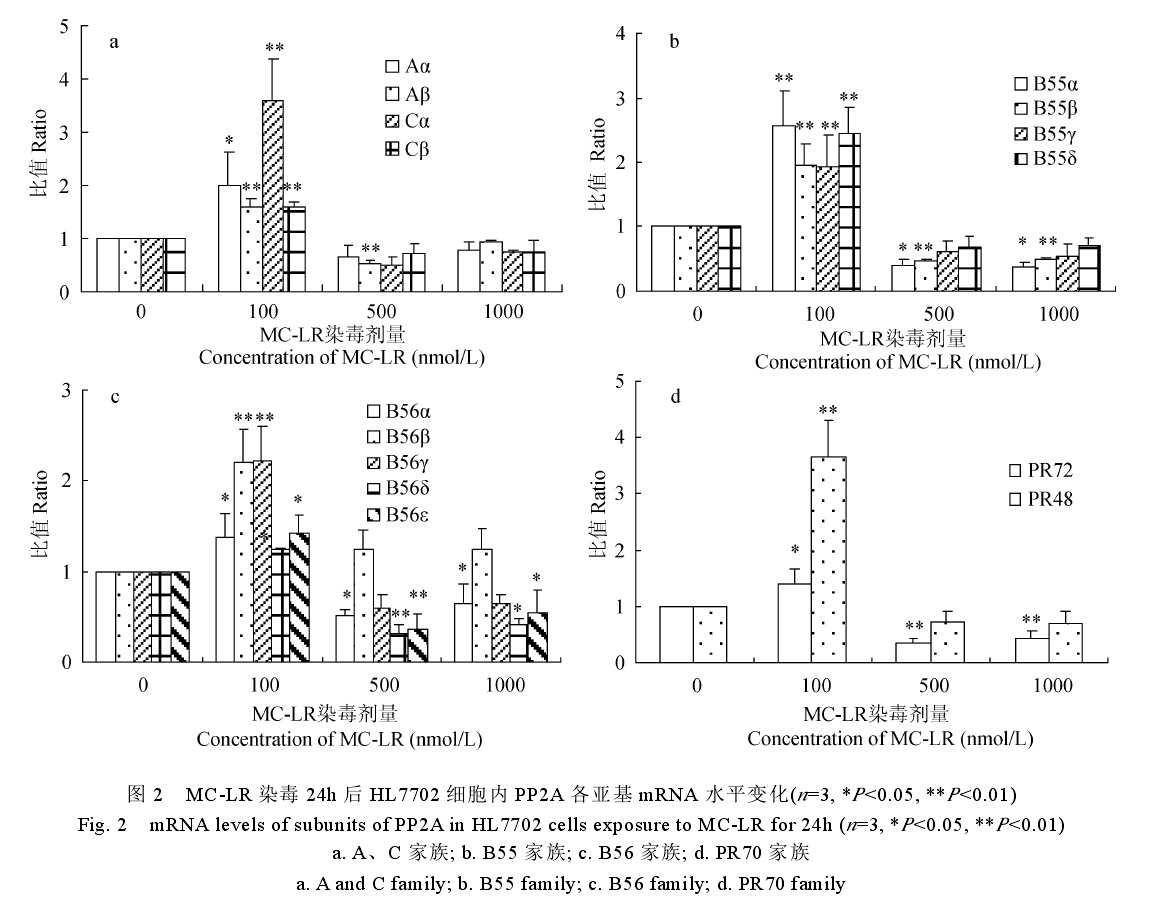 微囊藻素染毒劑量對細胞亞蛋白影響
微囊藻素染毒劑量對細胞亞蛋白影響 微囊藻毒素對細胞亞基蛋白影響
微囊藻毒素對細胞亞基蛋白影響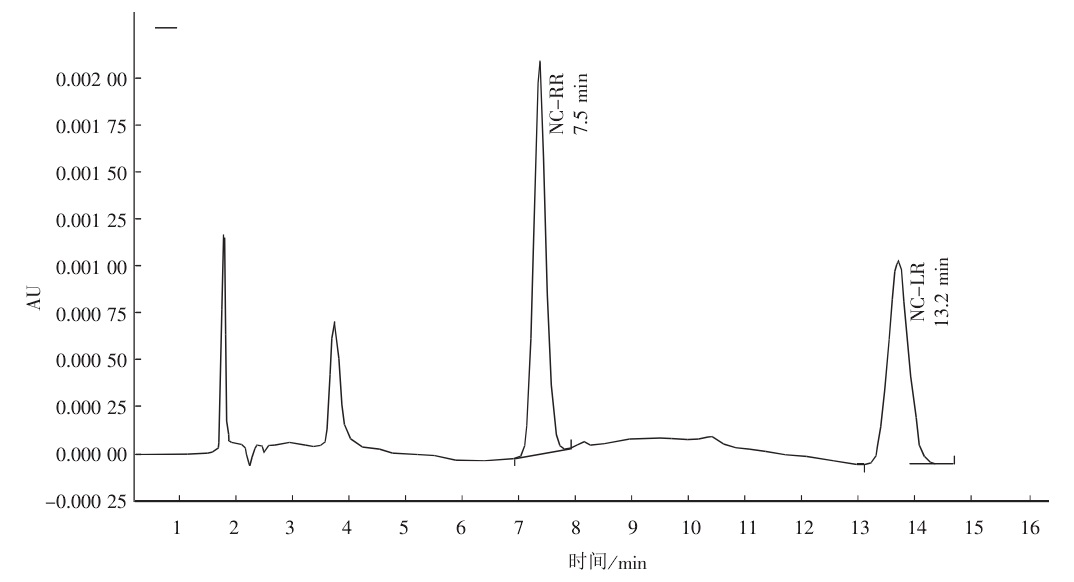 微囊藻毒素色譜
微囊藻毒素色譜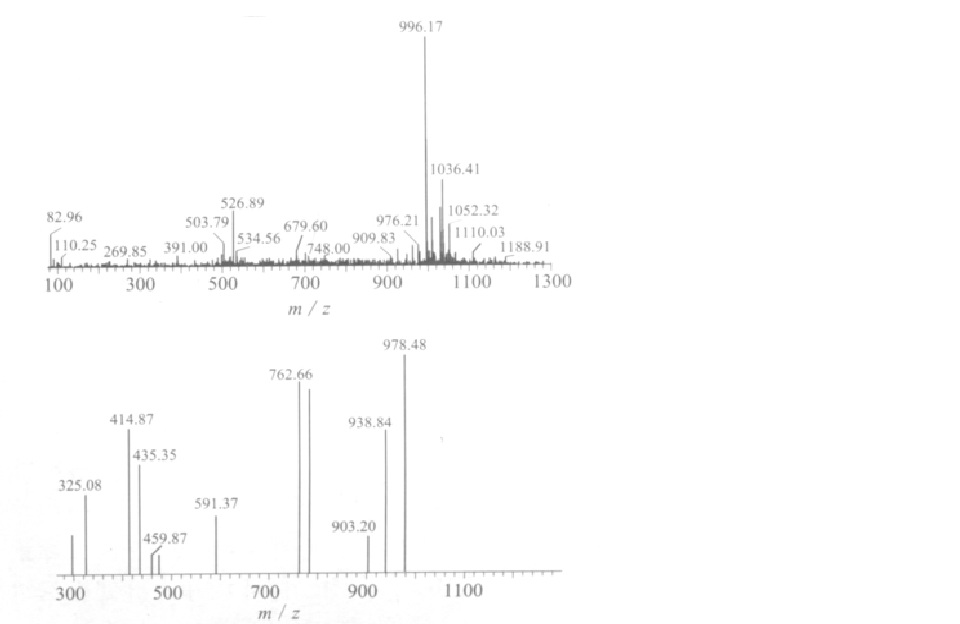 微囊藻素異構體HPLC-MS圖
微囊藻素異構體HPLC-MS圖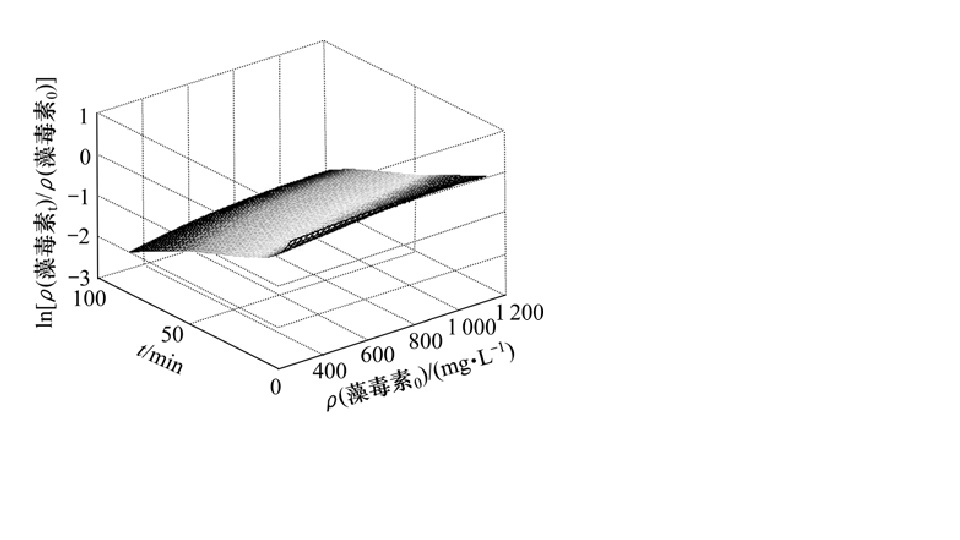 臭氧降解微囊藻素
臭氧降解微囊藻素