基本介紹
- 中文名:差速離心
- 外文名:differential centrifugation
基本原理
 差速離心
差速離心以蛋白質為例
 差速離心
差速離心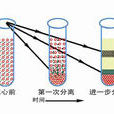
 差速離心
差速離心 差速離心
差速離心差速離心主要是採取逐漸提高離心速度的方法分離不同大小的細胞器。起始的離心速度較低,讓較大的顆粒沉降到管底,小的顆粒仍然懸浮在上清液中。收集沉澱,改用較高的...
差速離心技術是交替使用低速和高速離心,用不同強度的離心力使具有不同質量的物質分級分離的方法。此法適用於混合樣品中各沉降係數差別較大組分的分離。超速離心機的...
差速離心是根據顆粒大小和密度不同造成沉降速度(即沉降係數)的差異,通過分級提高離心轉速或高速與低速離心交替進行,使具有不同質量的顆粒樣品(或大分子)從混合液中...
在操作技術上,最常用的是差速離心和密度梯度離心。前者是交替使用低速和高速離心,用不同強度的離心力使具有不同質量的物質分級分離的方法。此法適用於混合樣品中各...
密度梯度區帶離心法又可分為兩種: (1)差速區帶離心法:當不同的顆粒間存在沉降速度差時(不需要像差速沉降離心法所要求的那樣大的沉降係數差)。在一定的離心力...
此法的優點是:①分離效果好,可一次獲得較純顆粒;②適應範圍廣,能像差速離心法一樣分離具有沉降係數差的顆粒,又能分離有一定浮力密度差的顆粒;③顆粒不會擠壓...
(1)差速離心:又叫分級離心法,是生化分離中最為常用的離心分離方法。它指採用低速和高速兩種離心方式交替使用,用不同強度的離心力使具有不同密度的物質分級分離的...
分為差速區帶超速離心和等密度超速離心。可通過離心設備及其部件、梯度、梯度介質的選擇以及操作條件的控制,使生物大分子獲得有效的分離、純化。例如:用差速離心法...
超速離心機差速離心 這種方法是選擇不同轉速的離心,分別分離各個不同組分。例如先用低速沉降大顆粒和上清液,在高速離心上清沉降中等顆粒,最後超速離心上清沉降小...
,離心試液的面至軸心的水平距離(cm)r,粒子半徑(cm)R,粒子密度(g/cm3)Q,混合液密度(g/cm3)L,混合液粘度(po)以上兩個公式就能確定各種差速離心的離心力和...
1)離心轉頭的選用:離心中常用的是角轉子和水平轉子。角轉子常用來差速離心分離s(沉降係數)值相差較大(1:10)的樣品。水平轉子常用於密度梯度和等密度離心。另有...
9.2差速離心分離 9.3簡易蔗糖密度屏障法 9.4非連續和連續梯度的套用 10.1大分子的速率區帶離心分離 10.2大分子等密度分離條件的選擇 10.3大分子的等密度梯度離...
《離心分離》是2008年8月由化學工業出版社出版的圖書,作者是金綠松、林元喜。...第1章 離心機發展與離心技術概述第2章 離心機與轉子第3章 差速離心...
差速離心只用於分離大小懸殊的細胞,更多用於分離細胞器。通過差速離心可將細胞器初步分離,常需進一步通過密度梯離心再行分離純化。2、密度梯度離心...
多數情況下, 微粒體是指在細胞勻漿和差速離心過程中獲得的由破碎的內質網自我融合形成的近似球形的膜囊泡狀結構,它包含內質網膜和核糖體兩種基本成分。在體外實驗中...
他們用差速離心法所得的稻普矮病毒(RDV)粗提取的抗原作兔肌肉注射,能獲得效價為2560的抗血清。當這項工作需要繼續深入時,又遇到缺少專用超速離心機的困難。這時,...
