奪取反應即反應過程中發生了電子的轉移。
電子轉移(Electron transfer,ET),是指電子在二個原子或其他化學物質(如分子等)之間的移動。電子轉移是一種氧化還原反應,會改變兩個反應物的氧化態。
基本介紹
- 中文名:奪取反應
- 含義:反應過程中發生了電子的轉移
- 本質:氧化還原反應
- 領域:無機化學
介紹,氧化還原,
介紹
內層電子轉移:在內層電子轉移過程中,參與氧化還原的原子是以共價鍵相鍵結,產生的橋接配體可能是永久性的,這時的電子轉移則是分子內電子轉移(intramolecular electron transfer)。然而大部分的共價鍵是短暫存在的,在電子轉移前形成,在電子轉移 後斷裂,這時則稱為分子間的電子轉移。像[CoCl(NH3)5]2+被[Cr(H2O)6]2+還原的例子就是內層電子轉移,其中有過渡性的橋接中間產物,橋接配體為氯離子,連線要氧化及還原的原子。
外層電子轉移:外層電子轉移機制可發生在不同或相同的化學物質間,差別在於氧化態的不同。相同化學物質間的例子又稱為自交換。以下舉了一個自交換的例子,描述了一個在高錳酸鹽跟一個少了一個電子的錳酸鹽(英語:manganate)之間的還原反應。
[MnO4] + [Mn*O4] → [MnO4] + [Mn*O4]
氧化還原
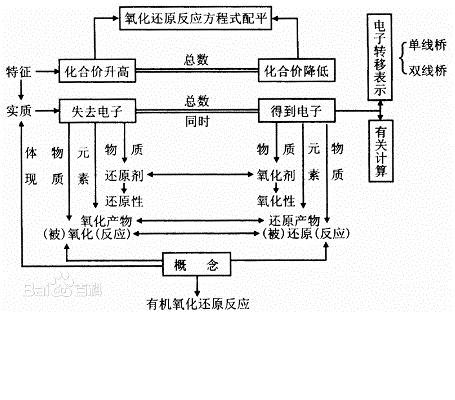
在無機反應中,有元素化合價升降,即電子轉移(得失或偏移)的化學反應是氧化還原反應。
物質失電子的作用叫氧化;相反的,得電子的作用叫還原。狹義的氧化反應指物質與氧化合;還原反應指物質失去氧的作用。氧化時氧化值升高;還原時氧化值降低。氧化、還原都指反應物(分子、離子或原子)。氧化也稱氧化反應。
即應看其是失去了電子(或電子對偏離),還是得到了電子(或電子對偏向)或者看其化合價是升高了還是降低了。
在反應物中:失去了電子(或電子對偏離)即為還原劑,其化合價升高。得到了電子(或電子對偏向)即為氧化劑,其化合價降低。