基本介紹
- 中文名:壓縮因子
- 外文名:compressibility factor
- 符號:Z
- 套用學科 :化學、物理
- 套用領域:實際氣體
- 別名:壓縮係數
定義
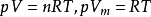

性質




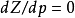
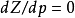




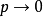

套用
臨界壓縮因子
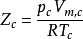
對比參數



圖形
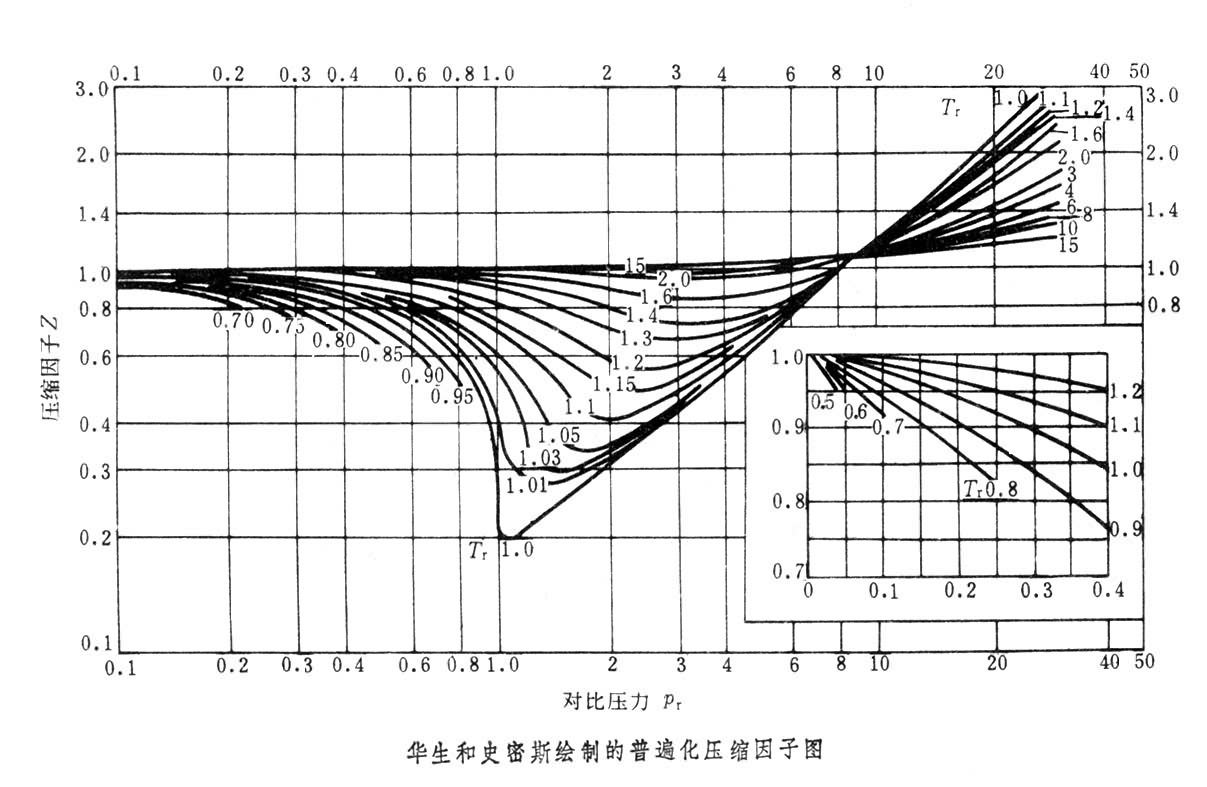 壓縮因子圖
壓縮因子圖
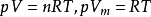





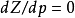
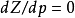





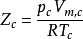



 壓縮因子圖
壓縮因子圖壓縮因子Z是理想氣體狀態方程用於實際氣體時必須考慮的一個校正因子,用以表示實際氣體受到壓縮後與理想氣體受到同樣的壓力壓縮後在體積上的偏差。校正後的方程,是描述...
通用壓縮因子圖是一種圖譜。...... 通用壓縮因子圖編輯 鎖定 本詞條缺少信息欄、名片圖,補充相關內容使詞條更完整,還能快速升級,趕緊來編輯吧!通用壓縮因子圖是一...
壓縮曲線反映了土受壓後的壓縮特性,它的形狀與土試樣的成分、結構、狀態以及受力歷史有關。壓縮性不同的土,其中,e-p曲線的形狀是不一樣的。假定試樣在某一...
氣體壓縮係數,也稱壓縮因子Compressibilityfactor。是實際氣體性質與理想氣體性質偏差的修正值。通常用Z表示,;Z也可以認為是實際氣體比容v(vactual)對理想氣體比容videal...
參數對應態原理,式中沒有任何參數,成為對任何氣體都可適用的方程式;換言之,對於不同的氣體,當具有相同的對比溫度和對比壓力時,則具有相同的對比體積(或壓縮因子)...
表2 天然氣中常見組分的壓縮因子、理想氣體體積低位熱值表序號 組分名稱 壓縮因子Z(20℃) 低熱值(1MJ/m) 1 甲烷 0.9981 33.367 2 乙烷 0.992 59.39...
維里展開式是按密度將壓縮因子展開成冪級數表達式的方程式。其形式為:Z=pV/RT=1+Bp+Cp2+...
在高壓下必須對理想氣體狀態方程進行修正, 即引入一係數Z, 從而得到天然氣的壓縮狀態方程為:式中, Z 通常稱為壓縮因子, 它是給定壓力和溫度下, 實際氣體占有的...
由於多數氣體的壓縮因子值相差不大,因此上式意味著處在相同的對應狀態的氣體,其壓縮因子值相近。換而言之,各種氣體處在偏離臨界態程度相同的狀態時,它們偏離理想...
天然氣偏差係數又稱壓縮因子,是指在相同溫度、壓力下,真實氣體所占體積與相同量理想氣體所占體積的比值。...
一般立方型狀態方程可用來計算液體的摩爾體積,但得到的結果準確度並不高。Lyderson等提出了一個基於對應態原理的估算液體體積的普遍化方法,它如同兩參數的氣體壓縮...
Amagat單位Anaa}at unit是壓縮因子的一種表達式.其定義是.4一pT.'I( P. V, )、i1是Ama}at單f;p、 j."、 r}c l}.標準狀態下,即在n℃和latm下的...
