基本介紹
- 中文名:四氧化釕
- 英文名:Ruthenium Tetroxide
- 化學式:RuO4
- 分子量:165.07
- CAS登錄號:20427-56-9
- EINECS登錄號:243-813-8
- 熔點:25.5℃
- 水溶性:微溶於水
- 密度:3.2921g/cm3
- 外觀:黃色固體
- 危險品運輸編號:3139
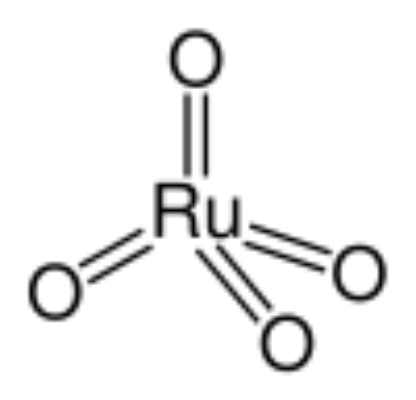
四氧化釕(Ruthenium Tetroxide),分子式為RuO4 ,分子量為165.07。為鉑系金屬釕的+VIII氧化態的四氧化物。金黃色針狀晶體,有揮發性及刺激氣味。有毒!熔點為25.5...
水溶性三氯化釕RuCl3·xH2O為棕紅色晶體。溶於水、酸、鹼,空氣中加熱至200℃分解。其水溶液紅色。由四氧化釕的鹽酸溶液在氯化氫氣流中加熱蒸發而得。與許多試劑...
用分別盛酸、鹼液串聯的吸收器來吸收鋨、釕的四氧化物時,由於酸吸收液中加有乙醇,鋨、釕四氧化物首先被還原為低價(6價或4價)並轉換為氯配合物H2RuCl6和H2O...
《現代有機合成試劑1:氧化反應試劑》歸納並總結了現代有機合成中常用的、重要的...四氧化釕四乙酸鉛碳酸銀-C鹽鐵氰化鉀硝酸鈰銨溴溴化銅N-氧化吡啶...
四氧化鋨(OsO4)和四氧化釕(RuO4)都是揮發性的有毒化合物,能刺激黏膜,侵害皮膚。鉑族金屬均為過渡金屬,有多個化合價,其穩定的化合價為:釕+3,銠+3,鈀+2、+...
[1]劉勇;郭凡修;徐端夫;.用四氧化釕染色法研究聚甲醛、共聚甲醛的單晶和球晶的形態結構[A].第五次全國電子顯微學會議論文摘要集.1988-10-01...
鈾的裂變產物中釕也能以四氧化釕的形式被蒸餾出來,蒸餾分離一般要用載體。此法分離的效果較好,但需時較長,且適用的元素種類較少。快速化學分離法 以分離時間短促...
3.4.3 氯釕酸銨763.5 鋨和銥的精細化工產品773.5.1 四氧化鋨773.5.2 氯銥酸和氯銥酸銨783.5.3 水合二氧化銥803.6 鉑族金屬的回收80...
4 3 3一氯三苯基膦合銠(Ⅰ)1214 3 4三氧化銠1224 4釕的精細化工產品1234 4 1四氧化釕和水合二氧化釕1234 4 2三氯化釕124...
7-氯-1-(2,2,2-三氟乙基)-2,3-二氫-5-(2-氟苯基)-1,4-苯並二氮雜卓(I) 用四氧化釕或三氧化鉻氧化,得化合物(Ⅱ)。1.8g(0.005mol)化合物(1I...
