基本介紹
- 中文名:呼吸鏈
- 外文名:respiratory chain
- 詞語分類:生物學術語
- 別名:電子傳遞鏈
- 構成:由一系列電子載體構成的
- 反應:按順序排列所組成的連續反應體系
定義
組成
複合體Ⅰ
複合體Ⅱ
輔酶Q
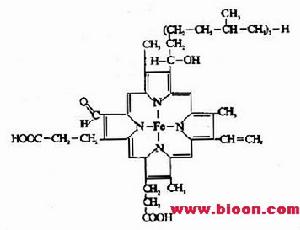
細胞色素類
遞電子體
NAD+
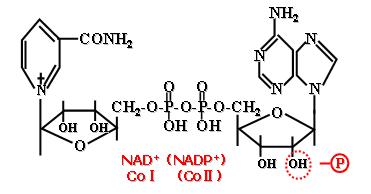 輔酶I與輔酶II
輔酶I與輔酶II黃素蛋白
鐵硫蛋白
泛醌
 呼吸鏈
呼吸鏈細胞色素體系
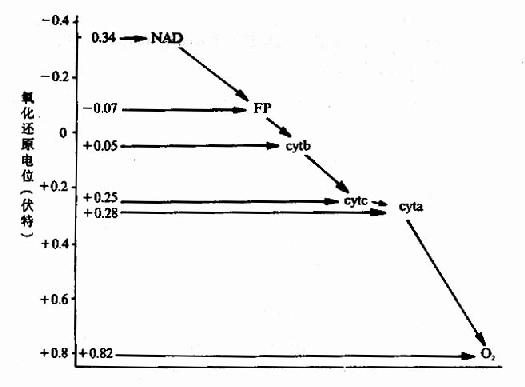 呼吸鏈
呼吸鏈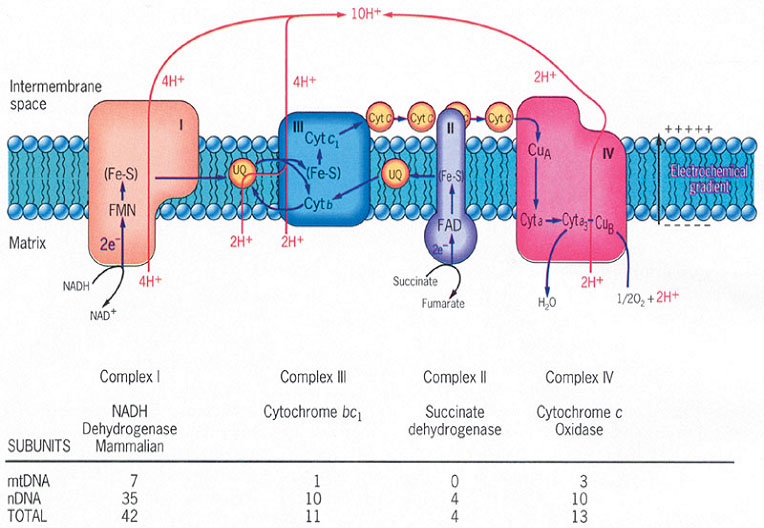
 輔酶I與輔酶II
輔酶I與輔酶II 呼吸鏈
呼吸鏈 呼吸鏈
呼吸鏈呼吸鏈(respiratory chain)是由一系列的遞氫反應(hydrogen transfer reactions)和遞電子反應(eletron transfer reactions)按一定的順序排列所組成的連續反應體系,它將...
氧化呼吸鏈,真核細胞ATP生成主要發生線上粒體中。營養物質代謝脫下的成對氫原子以還原當量形式存在,再通過多種酶和輔酶催化的氧化還原的連鎖反應逐步傳遞,最終與氧...
線粒體呼吸鏈,在生物細胞中,接受代謝物上脫下的氫(或電子)的載體有三種—— NAD+、NADP+和FAD。...
呼吸反應鏈是由一系列的遞氫反應(hydrogen transfer reactions)和遞電子反應(eletron transfer reactions)按一定的順序排列所組成的連續反應體系,它將代謝物脫下的成...
呼吸鏈複合物即NADH,輔酶Q複合體,由NADH(一種以FMN為輔基的黃素蛋白)和一系列鐵-硫中心)組成。它從NADH得到兩個電子,經鐵硫蛋白傳遞給輔酶Q。鐵硫蛋白含有非...
呼吸電子傳遞鏈(respiratory electron-transport chain):由一系列可作為電子載體的酶複合體和輔助因子構成,可將來自還原型輔酶或底物的電子傳遞給有氧代謝的最終的電子...
線粒體呼吸鏈酶也稱為線粒體呼吸鏈複合物、線粒體呼吸鏈複合酶。線粒體呼吸鏈位於線粒體內膜上,由5個複合物組成,分別為:NADH-Q氧化還原酶(也稱為複合物I)...
生物體內的有機物在細胞內經過一系列的氧化分解,最終生成二氧化碳、尿酸或其他產物,並且釋放出能量的總過程,叫做呼吸作用。呼吸作用,是生物體在細胞內將有機物氧化...
細胞呼吸(cellular respiration)是指有機物在細胞內經過一系列的氧化分解,生成二氧化碳或其他產物,釋放出能量並生成ATP的過程。在一定範圍內,細胞呼吸強度隨含水量的...
有氧呼吸是指細胞在氧的參與下,通過多種酶的催化作用,把葡萄糖等有機物徹底氧化分解,產生二氧化碳和水,釋放能量,生成大量ATP的過程。有氧呼吸是高等動、植物進行...
一般是指在無氧條件下,通過酶的催化作用,動植物細胞把糖類等有機物分解成為不徹底的氧化產物,同時釋放出少量能量的過程。無氧呼吸又稱厭氧呼吸,是一類呼吸鏈末端的...
好氧呼吸(aerobic respiration),是一種最普遍又最重要的生物氧化或產能方式,基質的氧化以分子氧(O2)作為最終電子受體。其特點是基質脫氫後,脫下的氫(常以[H]...
二羥丙酮還原為α-磷酸甘油,後者通過線粒體內膜,並被內膜上的α-磷酸甘油脫氫酶(以FAD為輔基)催化重新生成磷酸二羥丙酮和FADH2,後者進入琥珀酸氧化呼吸鏈,生成...
氧化磷酸化,生物化學過程,發生在真核細胞的線粒體內膜或原核生物的細胞質中,是物質在體內氧化時釋放的能量通過呼吸鏈供給ADP與無機磷酸合成ATP的偶聯反應。...
遞電子體是電子呼吸鏈的組成部分.,輔酶1、黃素酶和FP、輔酶Q傳遞鏈酶和輔酶線上粒體內膜上按一定的順序排列組成的遞氫和遞電子體系。主要由下列五類電子傳遞體...
活性氧(reactive oxygen species , ROS)是體內一類氧的單電子還原產物,,是電子在未能傳遞到末端氧化酶之前漏出呼吸鏈並消耗大約2 %的氧生成的,包括氧的一電子...
呼吸鏈(respiratorychain)又稱電子傳遞鏈,是肌質體內膜上一組酶的複合體。其功能是進行電子傳遞,H+的傳遞及氧的利用,最後產生H2O和ATP。...
