原電池[教學設計]針對全日制普通中學人民教育出版社教科書化學第一冊第4章第一節的內容,採用“提出問題——做出假設——設計方案——實驗驗證——得出結論——解釋反思——表達交流”的流程完成教學過程的設計。
基本介紹
- 中文名:原電池2
- 課時:2
- 科目:無機化學
- 教學對象:高一學生
基本信息,特徵分析,學習內容,教學目標,重點難點,策略選擇,教學媒體,流程圖,教學評價,備註反思,
【說明】:此教學設計任務由南京曉莊學院現代教育技術課程老師yqiong參與教師-維基星光計畫進行wiki教學而發布。此詞條為範例詞條,由黃晨淳選定主題並負責、參與現代教育技術課程的所有同學協作共同完成!
基本信息
教學環境:多媒體教室
特徵分析
由於學生之前沒有電化學的基礎,理解原電池原理有一定的難度。原電池原理和組成條件是本節課的重點,原電池原理是本節課的難點。本節教材設定了大量的探究教學素材,讓學生動手做實驗並觀察記錄實驗結果,富有深刻的探究教學思想內涵。
學習內容
把化學能轉化為電能的裝置叫原電池。
原電池的工作原理:原電池將氧化還原反應分開在兩個電極上發生。還原劑所失去的電子通過導線流向另一電電極,氧化劑再從電極上得到電子而被還原。
教學目標
1、知識:使學生了解原電池裝置,認識原電池的化學原理,形成原電池的條件,以及原電池中能量的轉化關係。
2、能力:培養和發展學生的觀察能力,思維能力、自學能力和實驗能力。
重點難點
[教學重點]:原電池的化學原理。
[教學難點]:原電池的化學原理和構成原電池的條件
策略選擇
[教學方法]:實驗探究法。
[教學用品]:投影儀、電流計、乾電池、Cu片、Zn片、導線、燒懷、稀H2SO4小黑板等。
教學媒體
課堂教學設計
[引入情境]:向學生展示乾電池、畜電池、以及原電池裝置等。
師:同學們這些都是什麼東西?
生:電池。
師:今天我們就用實驗來探究原電池的裝置、原電池的化學原理、形成原電池的條件以及原電池中能量的轉化等。
[板書]:原電池裝置、原電池的化學原理、形成原電池的條件以及原電池的能量轉化。
師:下面大家做實驗1,並如實填寫實驗報告(投影)
學生實驗探究一:
編號
實驗操作
現象
結論
1
把Zn片插入稀H2SO4中
Zn片上是否有氣泡產生
Zn與稀H2SO4反應
成什麼氣體
化學方程式:
離子方程式:
師:Zn與稀H2SO4反應生成了什麼氣體,是什麼反應?電子轉移的方向如何?
生:Zn與稱H2SO4反應生成了H2,是氧化還原反應,電子是從Zn原子轉移給H+。
師:我們知道,化學反應都伴隨著能量的轉化(如熱能、光能、電能等),如果我們把Zn與稀H2SO4放入試管中反應,時間稍長,試管就發熱,那么這個反應說明了什麼?
生:熱能,說明化學能轉化成了熱能。
師:對,回答得很好,下面我們來做實驗2,並如實填寫實驗報告(投影)
學生實驗探究二:
編號
實驗操作
現象
結論
2
把Cu片插入稀H2SO4中
Cu片上有無氣泡產生
說明Cu與稀H2SO4是否反應
師:為什麼Cu與稀H2SO4不反應呢?
生:Cu不活潑,Cu的金屬活動性排出(H)以後。
師:對大家分析得很好,下面我們來做實驗了,並如實填寫實驗報告。(投影)
學生實驗探究三:
編號
實驗操作
現象
結論
3
把Zn片和Cu片用導線連線後一齊插入稀H2SO4中
Cu片上有無泡產生Zn片上質量是否減少
Zn與溶解Cu片上有稀H2生成,電子是從
轉移到上。Zn片的反應是
,Cu極上的么應是
師:為什麼Cu片上有氣體成呢?這種氣體是什麼呢?Cu片是否參加反應呢?電子的轉移又如何呢?能量的變化又是怎樣的呢?等等引起學思考。
啟發誘導學生思考並明確:Cu片上有氣泡是H2,Cu並沒有參加反應(從溶液中的顏色可以知道),從實驗中觀察到,Zn片不斷在溶解。這說明了參加反應的金屬是Zn。通過分析知道,電子是從Zn極經導線流向Cu極,Zn失去電子變成Zn2+進入溶液(發生了氧化反應),深液中的H+從Cu極上獲得電子生成H2放出(發生了還原反應),兩極的反應式是:
Zn極:Zn-Ze→Zn2+
Cu極:2H++2e→H2↑
總的離子反應式是:Zn+2H+=Zn2++H2↑
總的化學方程式是:Zn+H2SO4=ZNSO4+H2↑
師:既然電子是從Zn片經導線流向Cu片,那么導線中就應該有電流存在(為什麼?),是否有電流存在呢?下面我們來做驗4,並如實填寫實驗報告。(投影)
學生實驗探究四:
編號
實驗操作
現象
結論
4
在導線中間接上電流計再把Zn、Cu片插入稀H2SO4
指針是否
偏傳
導線上是否有電流存在
在這個裝置中化學能轉變成了能
師:現在我們也經證實了導線上確實有電流存在,說明了這個裝置已經把化學能轉化成了電能,這種裝置就叫原電池。
[析書]:原電池—任何化學能轉化成電能的裝置,都叫原電池。
師:即然導線中有了電流,那么電流的方向如何呢?下面我們來做實驗5,並如實填寫實驗報告(投影)
學生實驗探究五:
編號
實驗操作
現象
結論
5
①先用乾電池判斷電流的方向。(電流計指針偏轉方向)②再用原電池判斷電流的方向(指針偏轉方向)
①乾電池:電流計指針向
②原電池:電流計指針向
偏轉。
原電池中:Zn是極,Cu是極。電子是從極流向極,
電流是從極流向極。
師:大家判斷得很正確,這就是原電池的化學原理。
[板書]:原電池的化學原理:在原電池中,電子是從負極(較活潑的金屬)經導線流向正極(較不活潑的金屬或碳棒),電流是從正極流向負極,負極失去電子發生氧化反應;正極獲得電子(常常是溶液中的H+或金屬離子獲得電子)發生了還原反應。這樣通過氧化——還原反應形成了電流,實現了化學能轉化成電能的過程。
師:是否任何金屬、任何溶液都能形成原電池呢?下面讓我們來做實險6,並如實填寫實驗報告:(投影)
學生實驗探究六:
編號
實驗操作
現象
結論
6
①用相同的Cu片或Zn片用導線連線好後插入稀H2SO4中;②把Zn片和Cu片用導線連線好後,插入酒精溶液中。
①電流計指針是否偏轉
②電流計指針是否偏轉
①有無電流產生
②有無電流產生
師:這說明了形成原電池是有條件的
[引入情境]:向學生展示乾電池、畜電池、以及原電池裝置等。
師:同學們這些都是什麼東西?
生:電池。
師:今天我們就用實驗來探究原電池的裝置、原電池的化學原理、形成原電池的條件以及原電池中能量的轉化等。
[板書]:原電池裝置、原電池的化學原理、形成原電池的條件以及原電池的能量轉化。
師:下面大家做實驗1,並如實填寫實驗報告(投影)
學生實驗探究一:
編號
實驗操作
現象
結論
1
把Zn片插入稀H2SO4中
Zn片上是否有氣泡產生
Zn與稀H2SO4反應
成什麼氣體
化學方程式:
離子方程式:
師:Zn與稀H2SO4反應生成了什麼氣體,是什麼反應?電子轉移的方向如何?
生:Zn與稱H2SO4反應生成了H2,是氧化還原反應,電子是從Zn原子轉移給H+。
師:我們知道,化學反應都伴隨著能量的轉化(如熱能、光能、電能等),如果我們把Zn與稀H2SO4放入試管中反應,時間稍長,試管就發熱,那么這個反應說明了什麼?
生:熱能,說明化學能轉化成了熱能。
師:對,回答得很好,下面我們來做實驗2,並如實填寫實驗報告(投影)
學生實驗探究二:
編號
實驗操作
現象
結論
2
把Cu片插入稀H2SO4中
Cu片上有無氣泡產生
說明Cu與稀H2SO4是否反應
師:為什麼Cu與稀H2SO4不反應呢?
生:Cu不活潑,Cu的金屬活動性排出(H)以後。
師:對大家分析得很好,下面我們來做實驗了,並如實填寫實驗報告。(投影)
學生實驗探究三:
編號
實驗操作
現象
結論
3
把Zn片和Cu片用導線連線後一齊插入稀H2SO4中
Cu片上有無泡產生Zn片上質量是否減少
Zn與溶解Cu片上有稀H2生成,電子是從
轉移到上。Zn片的反應是
,Cu極上的么應是
師:為什麼Cu片上有氣體成呢?這種氣體是什麼呢?Cu片是否參加反應呢?電子的轉移又如何呢?能量的變化又是怎樣的呢?等等引起學思考。
啟發誘導學生思考並明確:Cu片上有氣泡是H2,Cu並沒有參加反應(從溶液中的顏色可以知道),從實驗中觀察到,Zn片不斷在溶解。這說明了參加反應的金屬是Zn。通過分析知道,電子是從Zn極經導線流向Cu極,Zn失去電子變成Zn2+進入溶液(發生了氧化反應),深液中的H+從Cu極上獲得電子生成H2放出(發生了還原反應),兩極的反應式是:
Zn極:Zn-Ze→Zn2+
Cu極:2H++2e→H2↑
總的離子反應式是:Zn+2H+=Zn2++H2↑
總的化學方程式是:Zn+H2SO4=ZNSO4+H2↑
師:既然電子是從Zn片經導線流向Cu片,那么導線中就應該有電流存在(為什麼?),是否有電流存在呢?下面我們來做驗4,並如實填寫實驗報告。(投影)
學生實驗探究四:
編號
實驗操作
現象
結論
4
在導線中間接上電流計再把Zn、Cu片插入稀H2SO4
指針是否
偏傳
導線上是否有電流存在
在這個裝置中化學能轉變成了能
師:現在我們也經證實了導線上確實有電流存在,說明了這個裝置已經把化學能轉化成了電能,這種裝置就叫原電池。
[析書]:原電池—任何化學能轉化成電能的裝置,都叫原電池。
師:即然導線中有了電流,那么電流的方向如何呢?下面我們來做實驗5,並如實填寫實驗報告(投影)
學生實驗探究五:
編號
實驗操作
現象
結論
5
①先用乾電池判斷電流的方向。(電流計指針偏轉方向)②再用原電池判斷電流的方向(指針偏轉方向)
①乾電池:電流計指針向
②原電池:電流計指針向
偏轉。
原電池中:Zn是極,Cu是極。電子是從極流向極,
電流是從極流向極。
師:大家判斷得很正確,這就是原電池的化學原理。
[板書]:原電池的化學原理:在原電池中,電子是從負極(較活潑的金屬)經導線流向正極(較不活潑的金屬或碳棒),電流是從正極流向負極,負極失去電子發生氧化反應;正極獲得電子(常常是溶液中的H+或金屬離子獲得電子)發生了還原反應。這樣通過氧化——還原反應形成了電流,實現了化學能轉化成電能的過程。
師:是否任何金屬、任何溶液都能形成原電池呢?下面讓我們來做實險6,並如實填寫實驗報告:(投影)
學生實驗探究六:
編號
實驗操作
現象
結論
6
①用相同的Cu片或Zn片用導線連線好後插入稀H2SO4中;②把Zn片和Cu片用導線連線好後,插入酒精溶液中。
①電流計指針是否偏轉
②電流計指針是否偏轉
①有無電流產生
②有無電流產生
師:這說明了形成原電池是有條件的
流程圖
流程圖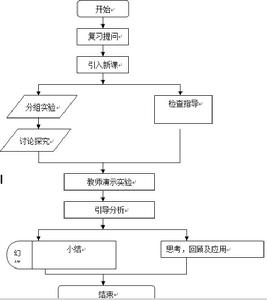 流程圖
流程圖
 流程圖
流程圖教學評價
編號 實驗操作 實驗現象 實驗結論 一 將鋅片插入稀硫酸中,觀察現象
鋅片上_氣泡產生,生成的氣體為_
化學方程式為 _
離子方程式為 _ 二 把Cu片插入稀H2SO4里 Cu片上 _ 氣泡產生
Cu與稀H2SO4_反應 三 把Zn片和Cu片用導線連線好 後一齊插入稀H2SO4中 Cu片上_ 氣體產生
Zn片質量_減少
活潑性:Zn_ Cu 電子是從_ 流向_
四 在導線中間接上電流計然後把 Zn和Cu一齊插入稀H2SO4中 電流計的指針_ 偏轉
導線上_ 有電流產生 化學能轉化成了_ 能 五
①先用乾電池確定電流的方向
②再用原電池判斷電流的方向。 ①乾電池,指針向_面偏轉
電子是從_流向_
②原電池,指針向_面偏轉
原電池中,Zn是原電池的_極
Cu是原電池的_極
六 ①用兩片Cu(或兩片Zu)連線後插入接稀H2SO4中,
②用Zn片和Cu片連線好後插入稀酒精中 ①電流計指針_發生偏轉
_電流產生
②電流計指針_發生偏轉 _電流產生
鋅片上_氣泡產生,生成的氣體為_
化學方程式為 _
離子方程式為 _ 二 把Cu片插入稀H2SO4里 Cu片上 _ 氣泡產生
Cu與稀H2SO4_反應 三 把Zn片和Cu片用導線連線好 後一齊插入稀H2SO4中 Cu片上_ 氣體產生
Zn片質量_減少
活潑性:Zn_ Cu 電子是從_ 流向_
四 在導線中間接上電流計然後把 Zn和Cu一齊插入稀H2SO4中 電流計的指針_ 偏轉
導線上_ 有電流產生 化學能轉化成了_ 能 五
①先用乾電池確定電流的方向
②再用原電池判斷電流的方向。 ①乾電池,指針向_面偏轉
電子是從_流向_
②原電池,指針向_面偏轉
原電池中,Zn是原電池的_極
Cu是原電池的_極
六 ①用兩片Cu(或兩片Zu)連線後插入接稀H2SO4中,
②用Zn片和Cu片連線好後插入稀酒精中 ①電流計指針_發生偏轉
_電流產生
②電流計指針_發生偏轉 _電流產生
編號 | 實驗操作 | 實驗現象 | 實驗結論 |
一 | 將鋅片插入稀硫酸中,觀察現象 | 鋅片上_氣泡產生,生成的氣體為_ 化學方程式為 _ 離子方程式為 _ | |
二 | 把Cu片插入稀H2SO4里 | Cu片上 _ 氣泡產生 Cu與稀H2SO4_反應 | |
三 | 把Zn片和Cu片用導線連線好 後一齊插入稀H2SO4中 | Cu片上_ 氣體產生 Zn片質量_減少 活潑性:Zn_ Cu | 電子是從_ 流向_ |
四 | 在導線中間接上電流計然後把 Zn和Cu一齊插入稀H2SO4中 | 電流計的指針_ 偏轉 導線上_ 有電流產生 | 化學能轉化成了_ 能 |
五 | ①先用乾電池確定電流的方向 ②再用原電池判斷電流的方向。 | ①乾電池,指針向_面偏轉 電子是從_流向_ ②原電池,指針向_面偏轉 原電池中,Zn是原電池的_極 Cu是原電池的_極 | |
六 | ①用兩片Cu(或兩片Zu)連線後插入接稀H2SO4中, ②用Zn片和Cu片連線好後插入稀酒精中 | ①電流計指針_發生偏轉 _電流產生 ②電流計指針_發生偏轉 _電流產生 |
把Zn片和Cu片用導線連線好
後一齊插入稀H2SO4中
在導線中間接上電流計然後把
Zn和Cu一齊插入稀H2SO4中
①電流計指針_發生偏轉
_電流產生
②電流計指針_發生偏轉
_電流產生
②電流計指針_發生偏轉
_電流產生
備註反思
1、通過學生一系列的實驗探究,更能提升學生對原電池原理的深刻認識。
2、通過學生一系列的實驗探究,更好地落實教學中的三維目標。
3、通過學生的一系列實驗探究,使學生更好地體驗探究知識的樂趣。
4、通過學生的一系列實驗探究,能更好地培養學生探究科學的意識和能力。
5、通過學生一系列的實驗探究,有利於學生好奇心的激發,學習動力的激發,更好地培養學生的學習興趣。
2、通過學生一系列的實驗探究,更好地落實教學中的三維目標。
3、通過學生的一系列實驗探究,使學生更好地體驗探究知識的樂趣。
4、通過學生的一系列實驗探究,能更好地培養學生探究科學的意識和能力。
5、通過學生一系列的實驗探究,有利於學生好奇心的激發,學習動力的激發,更好地培養學生的學習興趣。
