卡泊芬淨,是一種由Glarea Lozoyensis發酵產物合成而來的半合成脂肽 (棘白菌素,echinocandin)化合物。
卡泊芬淨能抑制許多絲狀真菌和酵母菌細胞壁的一種基本成份---β(1,3)-D-葡聚糖的合成,從而發揮抗真菌的作用。
基本信息,卡泊芬淨相關藥品說明書概況信息,通用名稱,功能主治,用法用量,注射用醋酸卡泊芬淨的溶解,製備注意,不良反應,禁忌,
基本信息
中文名稱:卡泊芬淨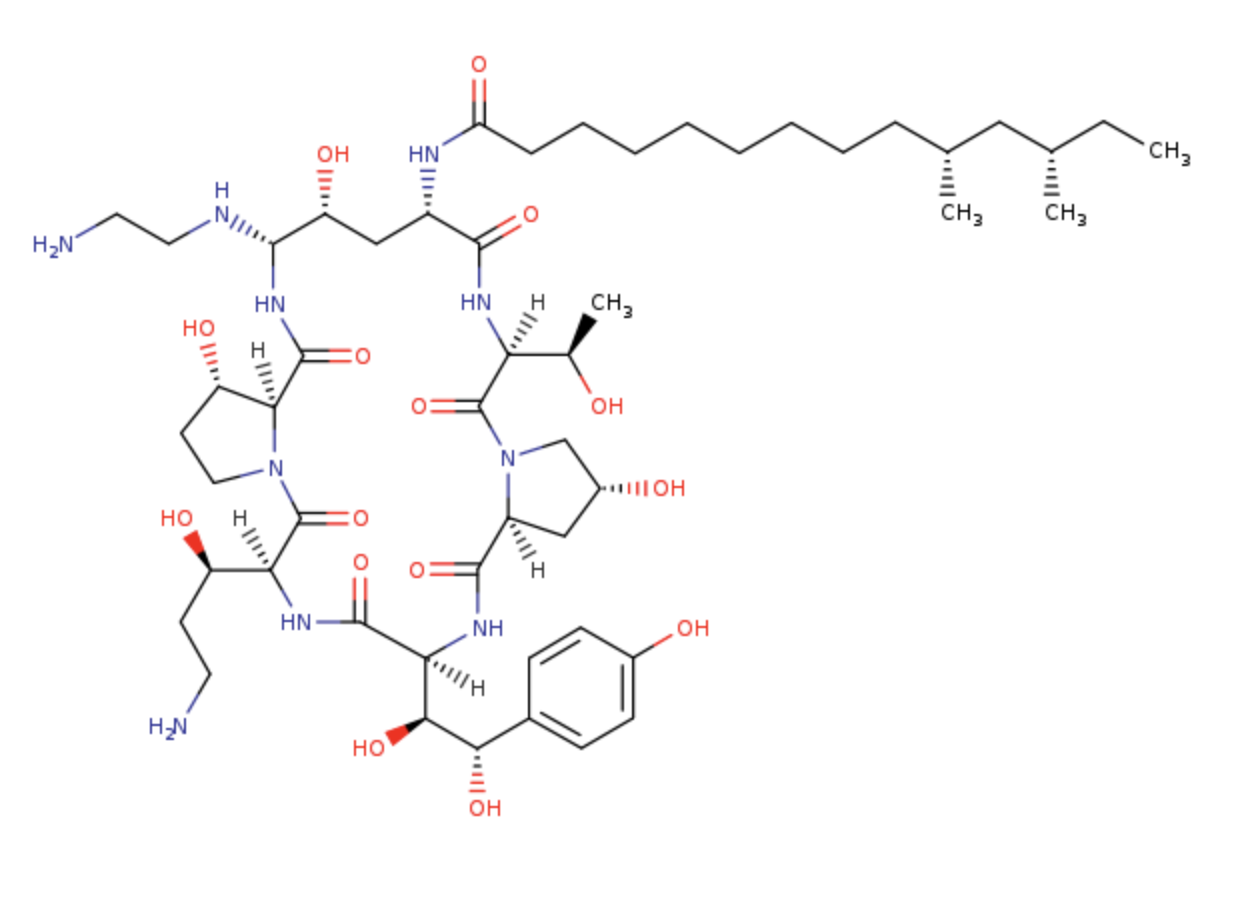

CAS NO: 162808-62-0
化學結構式:
英文名稱 :Caspofungin
分子式: C52H88N10O15
分子量: 1093.31
卡泊芬淨相關藥品說明書概況信息
通用名稱
·注射用醋酸卡泊芬淨
功能主治
本品適用於成人患者和兒童患者(三個月及三個月以上):經驗性治療中性粒細胞減少、伴發熱病人的可疑真菌感染治療對其它治療無效或不能耐受的侵襲性麴黴菌病。
用法用量
·成人患者一般建議
用於治療成人患者(18歲及18歲以上的),輸注液須大約1小時的時間經靜脈緩慢地輸注。
經驗性治療
第一天單次70mg負荷劑量,隨後每天單次50mg。療程取決於病人的臨床反應。經驗治療需要持續至病人的中性粒細胞恢復正常。確診真菌感染的病人需要至少14天的療程;在中性粒細胞恢復正常和臨床症狀消除後治療還需持續至少7天。如果50mg劑量耐受性好,但缺乏有效的臨床反應,可以將每天劑量升高至70mg。雖然尚無證據證明每天使用70mg劑量能夠提高療效,但現有的有限的安全性資料顯示每天劑量增加至70mg耐受性好。
侵襲性麴黴菌病
第一天給予單次70mg負荷劑量的注射用醋酸卡泊芬淨,隨後每天給予50mg的劑量。療程取決於病人疾病的嚴重程度、被抑制的免疫功能恢復情況以及對治療的臨床反應。雖然尚無證據證明使用更大的劑量能提高療效,但是現有的安全性資料提示,對於治療無臨床反應而對本品耐受性良好的病人可以考慮將每日劑量加大到70mg。
對老年病人(65歲或以上)無需調整劑量。
無需根據性別、種族或腎臟受損情況調整劑量。
成人患者:當本品與具有代謝誘導作用的藥物依非韋倫、奈韋拉平、利福平、地塞米松、苯妥英或卡馬西平同時使用時,應考慮給予每日劑量70mg。
肝臟功能不全的病人
對輕度肝臟功能不全(Child-Pugh 評分5至6)的成人患者無需調整劑量。但是對中等程度肝臟功能不全(Child-Pugh 評分7至9)的成人患者,推薦在給予首次 70mg負荷劑量之後,根據藥代動力學數據將本品的每日劑量調整為35mg。對嚴重肝臟功能不全(Child-Pugh 評分大於9)的成人患者和任何程度的肝臟功能不全兒童患者,目前尚無用藥的臨床經驗。
兒童患者
在兒童患者(3個月至17歲)中,本品需要大約1小時的時間經靜脈緩慢地輸注給藥。兒童患者(3個月至17歲)的給藥劑量應當根據患者的體表面積(參見兒童用藥說明,Mosteller1公式)。對於所有適應症,第1天都應當給予70mg/m2的單次負荷劑量(日實際劑量不超過70mg),之後給予50mg/m2的日劑量(日實際劑量不超過70mg)。療程可以根據適應症進行調整,各類適應症的療程在成人中都有表述(參見成人患者用藥的一般建議)。
如果50mg/m2的日劑量無法獲得足夠的臨床反應,但是患者又能很好地耐受,可以將日劑量增加到70 mg/m2(日實際劑量不超過70mg)。儘管70mg/m2的日劑量能否提高藥效尚缺乏證據,但是有限的安全性數據顯示,日劑量提升至70mg/m2仍能被很好地耐受。
在兒童患者中,當本品和代謝誘導劑(如利福平、依非韋倫、奈韋拉平、苯妥英、地塞米松或卡馬西平)聯合使用時,本品的日劑量可調整到70mg/m2(日實際劑量不超過70mg)。
用於治療成人患者(18歲及18歲以上的),輸注液須大約1小時的時間經靜脈緩慢地輸注。
經驗性治療
第一天單次70mg負荷劑量,隨後每天單次50mg。療程取決於病人的臨床反應。經驗治療需要持續至病人的中性粒細胞恢復正常。確診真菌感染的病人需要至少14天的療程;在中性粒細胞恢復正常和臨床症狀消除後治療還需持續至少7天。如果50mg劑量耐受性好,但缺乏有效的臨床反應,可以將每天劑量升高至70mg。雖然尚無證據證明每天使用70mg劑量能夠提高療效,但現有的有限的安全性資料顯示每天劑量增加至70mg耐受性好。
侵襲性麴黴菌病
第一天給予單次70mg負荷劑量的注射用醋酸卡泊芬淨,隨後每天給予50mg的劑量。療程取決於病人疾病的嚴重程度、被抑制的免疫功能恢復情況以及對治療的臨床反應。雖然尚無證據證明使用更大的劑量能提高療效,但是現有的安全性資料提示,對於治療無臨床反應而對本品耐受性良好的病人可以考慮將每日劑量加大到70mg。
對老年病人(65歲或以上)無需調整劑量。
無需根據性別、種族或腎臟受損情況調整劑量。
成人患者:當本品與具有代謝誘導作用的藥物依非韋倫、奈韋拉平、利福平、地塞米松、苯妥英或卡馬西平同時使用時,應考慮給予每日劑量70mg。
肝臟功能不全的病人
對輕度肝臟功能不全(Child-Pugh 評分5至6)的成人患者無需調整劑量。但是對中等程度肝臟功能不全(Child-Pugh 評分7至9)的成人患者,推薦在給予首次 70mg負荷劑量之後,根據藥代動力學數據將本品的每日劑量調整為35mg。對嚴重肝臟功能不全(Child-Pugh 評分大於9)的成人患者和任何程度的肝臟功能不全兒童患者,目前尚無用藥的臨床經驗。
兒童患者
在兒童患者(3個月至17歲)中,本品需要大約1小時的時間經靜脈緩慢地輸注給藥。兒童患者(3個月至17歲)的給藥劑量應當根據患者的體表面積(參見兒童用藥說明,Mosteller1公式)。對於所有適應症,第1天都應當給予70mg/m2的單次負荷劑量(日實際劑量不超過70mg),之後給予50mg/m2的日劑量(日實際劑量不超過70mg)。療程可以根據適應症進行調整,各類適應症的療程在成人中都有表述(參見成人患者用藥的一般建議)。
如果50mg/m2的日劑量無法獲得足夠的臨床反應,但是患者又能很好地耐受,可以將日劑量增加到70 mg/m2(日實際劑量不超過70mg)。儘管70mg/m2的日劑量能否提高藥效尚缺乏證據,但是有限的安全性數據顯示,日劑量提升至70mg/m2仍能被很好地耐受。
在兒童患者中,當本品和代謝誘導劑(如利福平、依非韋倫、奈韋拉平、苯妥英、地塞米松或卡馬西平)聯合使用時,本品的日劑量可調整到70mg/m2(日實際劑量不超過70mg)。
注射用醋酸卡泊芬淨的溶解
不得使用任何含有右旋糖(α-D-葡聚糖)的稀釋液,因為本品在含有右旋糖 的稀釋液中不穩定。不得將本品與任何其它藥物混合或同時輸注,因為尚無有關本品與其它靜脈輸注物、添加物或藥物的可配伍性資料。應當用肉眼觀察輸注液中是否有顆粒物或變色。
成人患者用藥說明:
第一步 溶解藥瓶中的藥物
溶解粉末狀藥物時,將儲存於冰櫃中的本品藥瓶置於室溫下,在無菌條件下 加入10.5mL的無菌注射用水、或含有對羥基苯甲酸甲酯和對羥基苯甲酸丙酯的無菌注射用水、或含有0.9%苯甲醇的無菌注射用水。溶解後瓶中藥液的濃度將分別為7.2mg/mL (每瓶70mg裝) 或5.2mg/mL ( 每瓶50mg裝)。
白色至類白色的藥物粉末會完全溶解。輕輕地混合,直到獲得透明的溶液。應對溶解後的溶液進行肉眼觀察是否有顆粒物或變色。保存於25°C或以下溫度的此溶液,在24小時之內可以使用。
第二步 配製供病人輸注的溶液
配製成供病人輸注用溶液的稀釋劑為:無菌注射用生理鹽水或乳酸化的林格氏溶液。供病人輸注用的標準溶液應在無菌條件下將適量已溶解的藥物(見下表)加入250mL的靜脈輸注袋或瓶中製備。如醫療上需要每日劑量為50mg或35mg,可將輸注液的容積減少到100mL。溶液渾濁或出現了沉澱,則不得使用。如輸注液儲存於25°C或以下溫度的環境中,必須在24小時內使用;如儲存於2至8°C的冰櫃中,則必須在48小時內使用。輸注液須用大約1小時經靜脈緩慢地輸注。
兒童用藥說明:
兒童給藥劑量的體表面積(BSA)計算公式
在配製輸注液之前,用以下公式計算患者的體表面積(BSA):(Mosteller公式)3個月以上兒童患者的70mg/m2輸注液的製備(取自一個70mg裝藥瓶)
1. 以患者的BSA(按上述公式計算)和以下方程式確定兒童患者的實際負荷劑量:
BSA (m2) × 70 mg / m2 = 負荷劑量
不管患者的計算劑量為多少,第1天的最大負荷劑量不應超過70mg。
2. 將冷藏的瓶裝本品置於室溫下復溫。
3. 在無菌條件下加入10.5mL的0.9%的氯化鈉注射液、無菌注射用水、或含有對羥基苯甲酸甲酯和對羥基苯甲酸丙酯的抑菌注射用水。a 溶解後的溶液在≤25°C (≤77°F)條件下放置時間不超過1小時。b 按此配製的卡泊芬淨的瓶裝終濃度為7.2 mg/mL。
4. 根據計算的負荷劑量(第一步),從藥瓶中抽取相應容積的溶液。在無菌條件下將此體積(mL)c的本品溶液轉移至裝有250mL 0.9%、0.45%或0.225%的氯化鈉注射液或乳酸林格氏液的靜脈輸注袋(或瓶)。此外,可以在無菌條件下將此體積(mL)c的本品溶液加入至減容後的0.9%、0.45%或0.225%的氯化鈉注射液或乳酸林格氏液,終濃度不超過0.5 mg/mL。將輸注液保存於≤25°C(≤77°F)溫度時,必須在24小時內使用,或2至8°C (36至46°F)冷藏時在48小時內使用。
5. 如果計算負荷劑量小於50mg,可採用50mg裝藥瓶來製備藥劑[參照3個月以上兒童患者的50 mg/m2輸注液的製備(取自一個50mg裝藥瓶)中的第2-4步]。50mg裝藥瓶內卡泊芬淨溶解後的終濃度為5.2 mg/mL。
3個月以上兒童患者的50 mg/m2輸注液的製備(取自一個50mg裝藥瓶)
1. 以患者的BSA(按上述公式計算)和以下方程式確定兒童患者的實際日維持劑量:
BSA (m2) × 50 mg / m2 = 日維持劑量
不管患者的計算劑量為多少,日維持劑量不應超過70mg。
2. 將冷藏的瓶裝本品置於室溫下復溫。
3. 在無菌條件下加入10.5mL的0.9%的氯化鈉注射液、無菌注射用水、或含有對羥基苯甲酸甲酯和對羥基苯甲酸丙酯的抑菌注射用水。a 溶解後的溶液在≤25°C (≤77°F)條件下放置時間不超過1小時。b 按此配製的卡泊芬淨的瓶裝終濃度為5.2 mg/mL。
4. 根據計算的日維持劑量(第一步),從藥瓶中抽取相應容積的溶液。在無菌條件下將此體積(mL)c的本品溶液轉移至裝有250mL 0.9%、0.45%或0.225%的氯化鈉注射液或乳酸林格氏液的靜脈輸注袋(或瓶)。此外,可以在無菌條件下將此體積(mL)c的本品溶液加入至減容後的0.9%、0.45%或0.225%的氯化鈉注射液或乳酸林格氏液,終濃度不超過0.5 mg/mL。將輸注液保存於≤25°C(≤77°F)溫度時,必須在24小時內使用,或2至8°C (36至46°F)冷藏時在48小時內使用。
5. 如果實際日維持劑量大於50mg,可採用70mg裝藥瓶來製備藥劑[參照3個月以上兒童患者的70mg/m2輸注液的製備(取自一個70mg裝藥瓶)中的第2-4步]。70mg裝藥瓶內卡泊芬淨溶解後的終濃度為7.2 mg/mL。
成人患者用藥說明:
第一步 溶解藥瓶中的藥物
溶解粉末狀藥物時,將儲存於冰櫃中的本品藥瓶置於室溫下,在無菌條件下 加入10.5mL的無菌注射用水、或含有對羥基苯甲酸甲酯和對羥基苯甲酸丙酯的無菌注射用水、或含有0.9%苯甲醇的無菌注射用水。溶解後瓶中藥液的濃度將分別為7.2mg/mL (每瓶70mg裝) 或5.2mg/mL ( 每瓶50mg裝)。
白色至類白色的藥物粉末會完全溶解。輕輕地混合,直到獲得透明的溶液。應對溶解後的溶液進行肉眼觀察是否有顆粒物或變色。保存於25°C或以下溫度的此溶液,在24小時之內可以使用。
第二步 配製供病人輸注的溶液
配製成供病人輸注用溶液的稀釋劑為:無菌注射用生理鹽水或乳酸化的林格氏溶液。供病人輸注用的標準溶液應在無菌條件下將適量已溶解的藥物(見下表)加入250mL的靜脈輸注袋或瓶中製備。如醫療上需要每日劑量為50mg或35mg,可將輸注液的容積減少到100mL。溶液渾濁或出現了沉澱,則不得使用。如輸注液儲存於25°C或以下溫度的環境中,必須在24小時內使用;如儲存於2至8°C的冰櫃中,則必須在48小時內使用。輸注液須用大約1小時經靜脈緩慢地輸注。
兒童用藥說明:
兒童給藥劑量的體表面積(BSA)計算公式
在配製輸注液之前,用以下公式計算患者的體表面積(BSA):(Mosteller公式)3個月以上兒童患者的70mg/m2輸注液的製備(取自一個70mg裝藥瓶)
1. 以患者的BSA(按上述公式計算)和以下方程式確定兒童患者的實際負荷劑量:
BSA (m2) × 70 mg / m2 = 負荷劑量
不管患者的計算劑量為多少,第1天的最大負荷劑量不應超過70mg。
2. 將冷藏的瓶裝本品置於室溫下復溫。
3. 在無菌條件下加入10.5mL的0.9%的氯化鈉注射液、無菌注射用水、或含有對羥基苯甲酸甲酯和對羥基苯甲酸丙酯的抑菌注射用水。a 溶解後的溶液在≤25°C (≤77°F)條件下放置時間不超過1小時。b 按此配製的卡泊芬淨的瓶裝終濃度為7.2 mg/mL。
4. 根據計算的負荷劑量(第一步),從藥瓶中抽取相應容積的溶液。在無菌條件下將此體積(mL)c的本品溶液轉移至裝有250mL 0.9%、0.45%或0.225%的氯化鈉注射液或乳酸林格氏液的靜脈輸注袋(或瓶)。此外,可以在無菌條件下將此體積(mL)c的本品溶液加入至減容後的0.9%、0.45%或0.225%的氯化鈉注射液或乳酸林格氏液,終濃度不超過0.5 mg/mL。將輸注液保存於≤25°C(≤77°F)溫度時,必須在24小時內使用,或2至8°C (36至46°F)冷藏時在48小時內使用。
5. 如果計算負荷劑量小於50mg,可採用50mg裝藥瓶來製備藥劑[參照3個月以上兒童患者的50 mg/m2輸注液的製備(取自一個50mg裝藥瓶)中的第2-4步]。50mg裝藥瓶內卡泊芬淨溶解後的終濃度為5.2 mg/mL。
3個月以上兒童患者的50 mg/m2輸注液的製備(取自一個50mg裝藥瓶)
1. 以患者的BSA(按上述公式計算)和以下方程式確定兒童患者的實際日維持劑量:
BSA (m2) × 50 mg / m2 = 日維持劑量
不管患者的計算劑量為多少,日維持劑量不應超過70mg。
2. 將冷藏的瓶裝本品置於室溫下復溫。
3. 在無菌條件下加入10.5mL的0.9%的氯化鈉注射液、無菌注射用水、或含有對羥基苯甲酸甲酯和對羥基苯甲酸丙酯的抑菌注射用水。a 溶解後的溶液在≤25°C (≤77°F)條件下放置時間不超過1小時。b 按此配製的卡泊芬淨的瓶裝終濃度為5.2 mg/mL。
4. 根據計算的日維持劑量(第一步),從藥瓶中抽取相應容積的溶液。在無菌條件下將此體積(mL)c的本品溶液轉移至裝有250mL 0.9%、0.45%或0.225%的氯化鈉注射液或乳酸林格氏液的靜脈輸注袋(或瓶)。此外,可以在無菌條件下將此體積(mL)c的本品溶液加入至減容後的0.9%、0.45%或0.225%的氯化鈉注射液或乳酸林格氏液,終濃度不超過0.5 mg/mL。將輸注液保存於≤25°C(≤77°F)溫度時,必須在24小時內使用,或2至8°C (36至46°F)冷藏時在48小時內使用。
5. 如果實際日維持劑量大於50mg,可採用70mg裝藥瓶來製備藥劑[參照3個月以上兒童患者的70mg/m2輸注液的製備(取自一個70mg裝藥瓶)中的第2-4步]。70mg裝藥瓶內卡泊芬淨溶解後的終濃度為7.2 mg/mL。
製備注意
a 白色至類白色的緻密粉劑會完全溶解。輕輕混合,直到獲得透明溶液。
b 在溶解過程中和注射之前,應以肉眼觀察溶解後的溶液是否有顆粒物或變色。溶液出現渾濁或沉澱時不得使用。
c 本品製劑可以確保從裝藥瓶中抽取的10mL溶液獲得全部標註劑量(70mg或50mg)。
b 在溶解過程中和注射之前,應以肉眼觀察溶解後的溶液是否有顆粒物或變色。溶液出現渾濁或沉澱時不得使用。
c 本品製劑可以確保從裝藥瓶中抽取的10mL溶液獲得全部標註劑量(70mg或50mg)。
不良反應
·已報告的不良反應中包括可能由組胺介導的症狀,其中包括皮疹、顏面腫脹、瘙癢、溫暖感或支氣管痙攣。使用本品治療的患者中出現了過敏反應報告。
成人患者
在臨床研究中已有1865成人使用過單劑或多劑注射用醋酸卡泊芬淨:564名發熱性中性粒細胞減少的病人(經驗治療研究),382名侵襲性念珠菌病病人,297名患有食道念珠菌病和/或口咽念珠菌病的病人,228名侵襲性麴黴菌病的病人和394名I期臨床的參加者。在經驗治療研究中病人均接受過惡性腫瘤的化療或進行過造血幹細胞移植。在有明確診斷的念珠菌感染的病人進行的研究中,大多數病人的病情非常嚴重(例如血液系統惡性腫瘤或其他腫瘤,近期大的手術,愛滋病),需要同時進行多種治療手段。在無對照的麴黴菌病研究中,病人的病情均嚴重,而且原有的疾病又複雜(例如骨髓或外周血幹細胞移植,血液惡性腫瘤,實體瘤或器官移植),需要同時進行多種治療手段。
在所有接受本品治療的成人(總數989人)中,已報告與藥物有關的臨床和實驗室檢查異常一般都是輕微的,而且極少導致停藥。
上市後經驗:
已報導有下列上市後不良事件的發生:
肝膽:罕見的肝臟功能失調
心血管:腫脹和外周浮腫
實驗室異常:高鈣血症
實驗室檢查發現:
已報告與藥物有關的其它實驗室檢查異常有:低白蛋白、低鉀、低鎂血症、白細胞減少、嗜酸性粒細胞增多、血小板減少、中性白細胞減少、尿中紅細胞增多、部分凝血激酶時間延長、血清總蛋白降低、尿蛋白增多、凝血酶原時間延長、低鈉、尿中白細胞增多以及低鈣。
兒童患者
在兒童患者中,其他報告的藥物相關的實驗室檢查異常結果為低鉀、低鎂血症、血糖增高、磷降低、磷增加和嗜酸性粒細胞增多。
成人患者
在臨床研究中已有1865成人使用過單劑或多劑注射用醋酸卡泊芬淨:564名發熱性中性粒細胞減少的病人(經驗治療研究),382名侵襲性念珠菌病病人,297名患有食道念珠菌病和/或口咽念珠菌病的病人,228名侵襲性麴黴菌病的病人和394名I期臨床的參加者。在經驗治療研究中病人均接受過惡性腫瘤的化療或進行過造血幹細胞移植。在有明確診斷的念珠菌感染的病人進行的研究中,大多數病人的病情非常嚴重(例如血液系統惡性腫瘤或其他腫瘤,近期大的手術,愛滋病),需要同時進行多種治療手段。在無對照的麴黴菌病研究中,病人的病情均嚴重,而且原有的疾病又複雜(例如骨髓或外周血幹細胞移植,血液惡性腫瘤,實體瘤或器官移植),需要同時進行多種治療手段。
在所有接受本品治療的成人(總數989人)中,已報告與藥物有關的臨床和實驗室檢查異常一般都是輕微的,而且極少導致停藥。
上市後經驗:
已報導有下列上市後不良事件的發生:
肝膽:罕見的肝臟功能失調
心血管:腫脹和外周浮腫
實驗室異常:高鈣血症
實驗室檢查發現:
已報告與藥物有關的其它實驗室檢查異常有:低白蛋白、低鉀、低鎂血症、白細胞減少、嗜酸性粒細胞增多、血小板減少、中性白細胞減少、尿中紅細胞增多、部分凝血激酶時間延長、血清總蛋白降低、尿蛋白增多、凝血酶原時間延長、低鈉、尿中白細胞增多以及低鈣。
兒童患者
在兒童患者中,其他報告的藥物相關的實驗室檢查異常結果為低鉀、低鎂血症、血糖增高、磷降低、磷增加和嗜酸性粒細胞增多。
禁忌
對本品中任何成份過敏的病人禁用。
