基本介紹
- 中文名:加氫醯化反應
- 外文名:Hydroacylation
- 條件:金屬催化劑參與
- 相關學科:金屬有機化學
- 用途:製備醛、酮化合物
簡介,舉例,反應機理,不對稱加氫醯化,
簡介
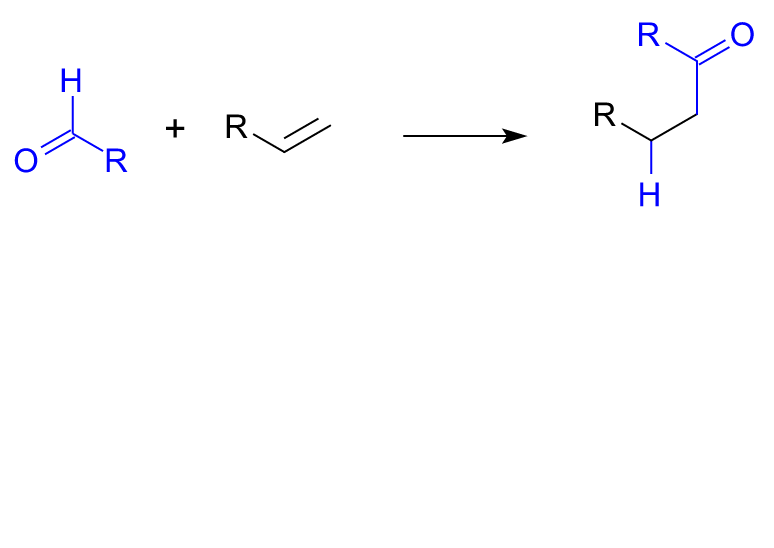
加氫醯化反應,英文名稱為hydroacylation。它是指含有不飽和鍵(例如烯烴)的有機化合物發生加氫和醯基化(醯化)而生成飽和羰基化合物的反應。反應過程中需要一定的金屬催化劑參與到反應,主要涉及金屬試劑對C-H鍵氧化加成生成金屬化合物,之後對不飽和鍵的插入、還原消除最終得到加氫醯化的產物。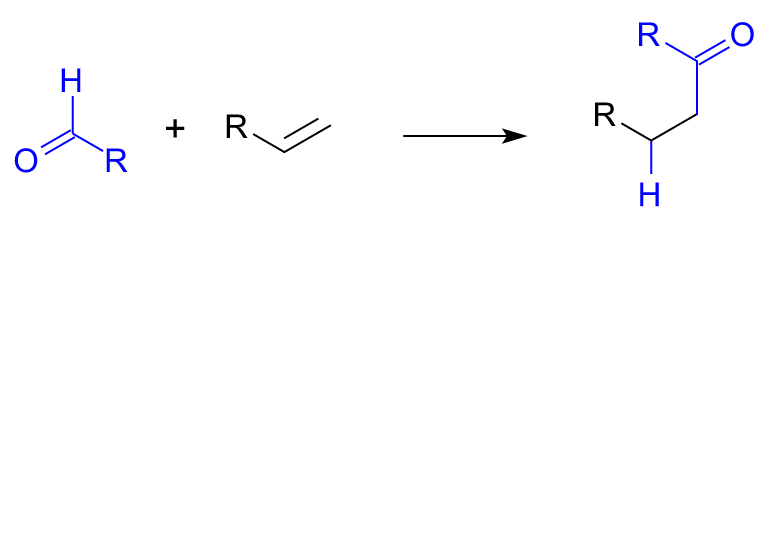 加氫醯化通式
加氫醯化通式
 加氫醯化通式
加氫醯化通式舉例
該反應最早發現於1972年,化學家K.Sakai合成一種前列腺素的路線就套用了此類化學反應。在該加氫醯化反應中,四氯化錫作為反應試劑,並套用了等當量的威爾金森催化劑的氯仿、乙腈或苯溶液作為催化劑。反應由於脫羰作用生成了等當量的環丙烷。如下圖所示的反應方程式,該反應的收率達42%。
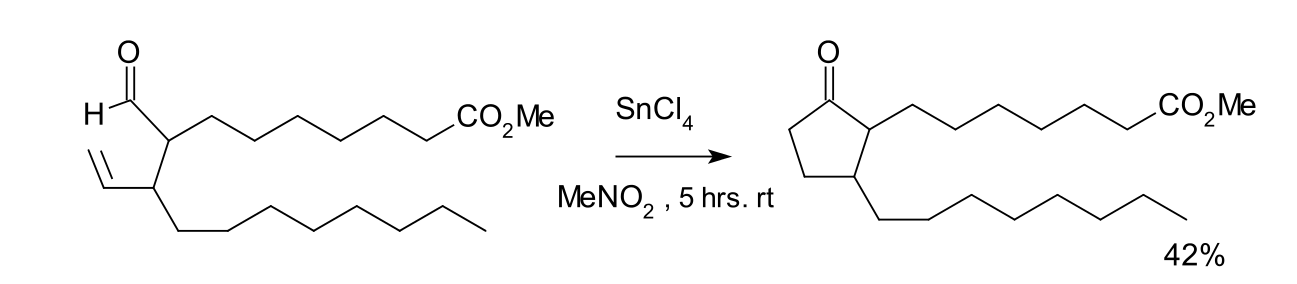 前列腺素套用加氫醯化的方法合成反應式
前列腺素套用加氫醯化的方法合成反應式首個該反應的催化套用於1976年被化學家米勒報導,該反應中,在威爾金森催化劑與飽和的乙烯溶液的條件下,可將4-戊烯醛轉化為環戊酮。該反應的收率達72%。另一種合適的催化劑為銠正離子絡合物Rh(dppe)ClO4。
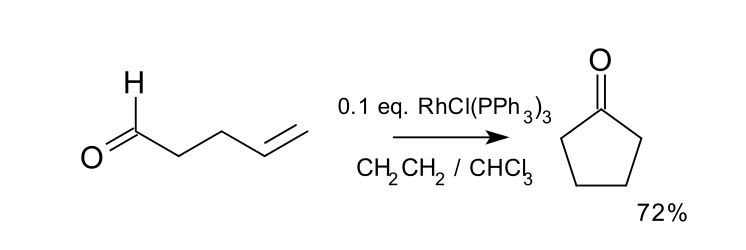 加氫醯化套用於環戊酮的合成
加氫醯化套用於環戊酮的合成反應機理
通常的反應機理為:第一步金屬對醛碳-氫鍵的氧化加成,而後對烯烴的加成,最後發生還原消除。一種可能產生的副反應為,醯基金屬氫化物RCH2(CO)MH通過中間體RCH2M(CO)H的脫羧反應,形成烷烴RCH3與M(CO)。如下圖所示的循環機理。
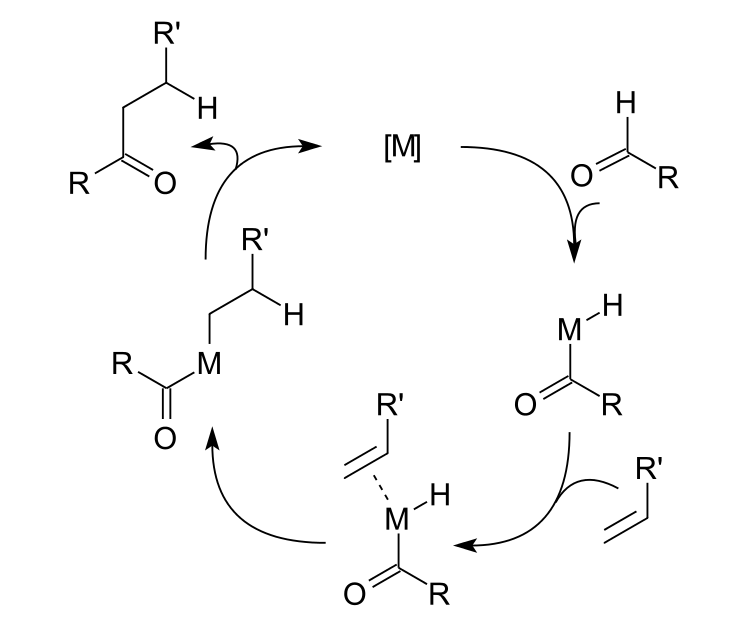 加氫醯化機理
加氫醯化機理不對稱加氫醯化
第一例加氫醯化的不對稱反應被首先於1983年被化學家James與Young發表(動力學拆分),1989年由Sakai發表了不對稱合成法,他們都套用了銠催化劑並使用了手性的二膦配體,如下圖所示的Me-DuPhos。該反應中收率達85%,ee值大於95%。是一個很好的選擇性反應。
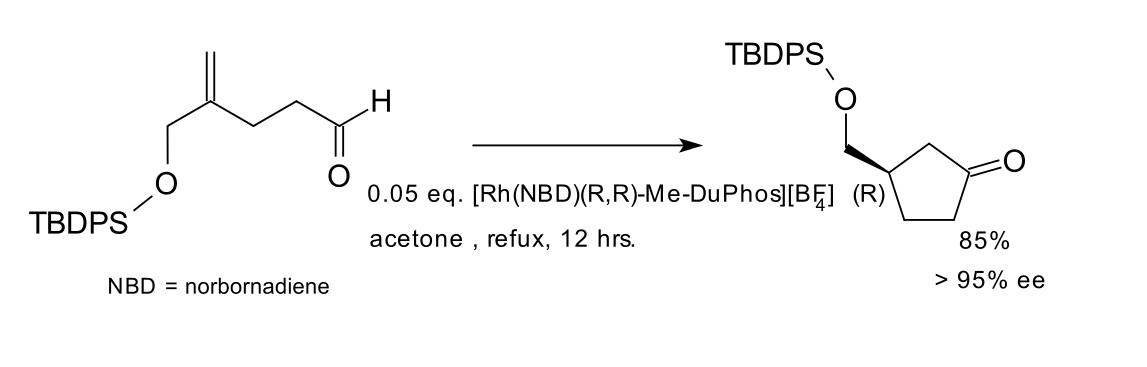 不對稱加氫醯化
不對稱加氫醯化