分子軌域的理論基礎是建立在原子軌域的概念上:一個重要的原則是線性相加(linear combination of atomic orbitals)。亦即是說:分子軌域就是一堆原子軌域加加減減而已。它用的函式與描述原子軌域的函式是相同的,並沒有建立新的函式關係。
基本介紹
- 中文名:分子軌域理論
- 套用學科:線性相加
- 適用領域範圍:σ鍵、π鍵
- 適用領域範圍:建立在原子軌域的概念上
介紹,基礎,結論,
介紹
欲了解化學分子中電子分布的情況,目前較完整的理論即是分子軌域理論(Molecular Orbital Theory)。通常在大一的普通化學課程內容中會作簡單的介紹,其實在高中化學課程中也已具有σ鍵、π鍵的概念了,只是不甚完整。而普化內容中僅談到最簡單的雙原子分子,當分子變大或其中所含原子數目較多時,分子軌域很快就變得很複雜。通常要到研究所的階段,我們才有需要更進一步了解其中詳情。在實用上為了簡化,價鍵理論(Valence Bond Theory)配合一點原子軌域的基本概念,通常已足夠適用於描述一般的化學反應。特別是對於有機化學研究者而言,分子軌域的知識是十分有用,但是又嫌太複雜沒有時間精力去弄清楚。
價鍵理論比較簡單,但它主要的缺點是討論問題時其著眼點僅集中在發生變化的那一特定地域內,而忽略其他部分的影響。分子軌域理論能作整體的考量,舉例而言,若以常用的電子點表示法描述氮分子時(N2)產生兩個孤電子對(lone pair electrons)如下:
:N≡N:
這兩個孤電子對看來似乎完全相同,那麼它們的能量是不是也一樣?氮與氮之間有個三鍵,這三個鍵的性質是否完全一樣?類似如此有關電子分布的訊息,唯有分子軌域理論可以提供正確的答案。
又譬如一般人對甲烷(CH4)的結構再也明白不過了,中心碳形成四面體結構,各以SP3混成軌域與氫原子形成四根完全相同的共價σ鍵。這四個鍵既然全等,那麼八個電子的能量是否也應該一樣?事實不然,分子軌域理論估算這八個電子應分散在兩個能階上,而軌域的形狀仍類似原子軌域s及p,看不出有所謂的「四根獨立的σ鍵」結構。許多有經驗的有機化學家恐怕對甲烷的電子結構都沒有正確的概念。
基礎
筆者的專業是有機化學,有機化學家們多半不喜歡數學方程式。分子軌域理論里用一大堆波函式導來導去令人頭昏,而且筆者也不相信大自然每發生一件事都需先算上半天才動作。不過話說回來,有機化學家們也不得不佩服理論化學家,因為他們算來算去,竟然真的可以預測大自然發生的事情。
在一堆原子軌域加加減減當中,有些原子軌域間的作用力強些,而有些弱些,這便造成了差異性及各種變化。有兩個主要的規則來判定軌域間作用力的強與弱:(一)相對間的能量差異:兩原子軌域能量愈相近時作用力愈強,反之則愈弱;所以外層電子與內層電子作用力弱,是因為兩者位能差異大之故。(二)兩者間的對稱性:對稱性相同的會互相作用,對稱性相反的不會作用;如在同一軸上的Px軌域與Px軌域會作用,而垂直的Px與Py軌域間無作用。
雙氮分子軌域
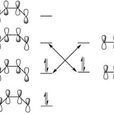
首先我們須要知道σ鍵與π鍵的差異。σ鍵的電子集中在連線兩原子核的中心軸上;π鍵的電子則分布在此軸的外方。如圖一顯示兩個氫原子的ls軌域重疊時,會形成兩個σ鍵。一個能量較低稱為σ鍵結軌域;另一個能量較高稱為σ*反鍵結軌域。兩個ls原子軌域生成兩個分子軌域σ及σ*(軌域不滅)。兩軌域σ、σ*能量和等於兩個1s軌域(能量不滅)。
p軌域的結合情形有兩種:一種是在兩核連線上軌域重疊形成σ及σ*鍵(圖二);另一種是平行排列的p軌域靠近時,生成π及π*鍵結(圖三),對第二周期的元素而言(如氮、氧、碳原子等),σ軌域的重疊性比π軌域佳,故σ、σ*之間的能量分裂情形也比π、π*之間來的大。這種能量分裂愈大則形成共價鍵的效果愈好,因為本來在原子軌域裡的單電子(↑)會進入σ鍵中配成對(↑↓)而放出較多的能量。至於高能量的σ*軌域是虛的,裡面沒有電子當然就無實質能量。
依據圖一、二、三的原則,我們可以作成圖四來表示雙氮分子N2的分子軌域。普通化學課本里教到的內容大概到此為止,可是實驗測試N2的電子能階與圖四稍有差異。那麼問題在哪裡?
軌域的對稱性
我們在前面中提到σ鍵生成時,可經由原子的s或Px軌域。在圖一及圖二的情形是分開處理的。經此步驟所得的σ(2s)、σ*(2s)、 σ(2p)及σ*(2p)四個鍵的相對能量(圖四)並不符合實測的數值。這四個鍵中對稱性相同的,其相互之間應會再產生作用,故須作進一步的處理。
所謂「對稱性」是否相同,是視各軌域的電子分布是否對於兩核連線的中點(inversioncenter)具有對稱的性質而定。軌域圖中的任何一點,通過此點後延伸等長的距離後反折出另外一點。若此兩點的相位相同(白或黑的顏色相同),則稱此軌域對中心點有對稱性(用g表示),若此兩點的相位相反(黑白變色),則稱此軌域對中心點不具對稱性(用u表示)。我們所談的這些分子軌域,皆可用u或g表示出它的對稱屬性。屬性相同的軌域會產生作用,屬性不同的軌域間不會發生作用,前面所提到的四個σ軌域,若加上u或g的屬性則成為σg(2s)、σu*(2s)、σg(2p)及σu*(2p)。其中σg(2s)與σg(2p)所屬的對稱性質相同,而σu*(2s)與σu*(2p)也相同,故此兩對軌域間的相對能量應再作一調整,才能解得出這些軌域中電子的真正能階。
軌域的混成
我們也可以用另一種方法來處理這四個σ軌域間的作用。便是先把s原子軌域與p原子軌域混成一番,形成兩個sp混成軌域,然後用sp混成軌域來組合成分子軌域。
在圖五的上方可以見到s與p軌域相加或相減後產生兩個sp混成軌域的示意圖。當兩個不同原子上的sp混成軌域互相靠近形成分子軌域時,其變化的情形也顯示在圖五中,四個分子軌域以符號表示為2σu*、3σg、3σu*及2σg,其中2σg與3σg對稱屬性相同,為鍵結軌域;而2σu*及3σu*的對稱屬性也相同,為反鍵結軌域。若依其鍵結性質排列它們的能量,則2σg與3σg的能量應低於2σu*及3σu*,如圖六左邊所示。但因對稱屬性相同的軌域之間會再互相產生能量消長,因而最後造成3σg的能量高過2σu*。其變化情形以圖六表示之。
在原來圖四的能階圖中,p軌域形成的σg(2p)的能量是低於πu(2p)的。因為對稱性相同軌域之間互相作用的影響,在修正的圖七能階中,3σg的能量高於πu(2p)。在圖七中我們也可以清楚地看出2σg、2σu*、3σg及3σu*四個分子軌域與混成的sp軌域之相對應關係。
現在我們可以回到本文開始時提出的最早的問題了。以價鍵模型描述的N2分子,其外層軌域應有一個三鍵,及兩對孤電子對。那麼對應到圖七的分子軌域能階圖中,何者是三鍵而何者又是那兩個孤電子對呢?
電子的分布情形如以圖形來描述,比用符號易明了得多。軌域圖通常以圖五中的示意圖表示,較為簡明更詳實的圖可見圖八。在圖八中,讀者很容易判斷出所謂三鍵是包括2σg及兩個πu軌域,那麼剩下的2σu*及3σg即應是所謂的兩個孤電子對了。
這兩個「孤電子對」的能量顯然不同!事實上每個電子都同時運轉於兩個氮原子核周圍。2σu*及3σg的軌域都有一個特徵;即是有相當大的部分位於兩核之外方,這點較符合「孤電子對」的概念。只有運用分子軌域的概念,我們才能真正明了這兩對電子的特質!
CO與N2分子
N2分子上的兩個孤電子雖然能量不等,但因N2分子左右對稱,所以這些電子的分布也是左右不分的。一氧化碳分子(CO)與氮分子的電子數目相同,而氧、碳、氮皆是同一周期的元素,有同樣的原子的軌域,故CO與N2分子軌域也應大同小異。唯一較大的差別是CO分子左右不對稱。
碳原子與氧原子的陰電性也不一樣。陰電性高的原子其中電子的位能較低,這是因為電子受原子核吸引力較強之故。如果把CO的分子軌域能階圖如同N2分子一樣的排列出來,其中最明顯的差異便是C原子的兩個sp混成軌域的能量比O原子的兩個sp混成軌域的能量高(見圖九)。我們前面曾說過,軌域間的能量差距愈大的,其作用力愈弱。因此當C和O的四個混成sp軌域相接近時,最強的作用力來自C的低階sp及O的高階sp軌域之間。而C上的高能階sp和O上的低能階sp軌域真正的變為非鍵結軌域(nonbonding orbital)。
由圖十上我們可見到這兩個非鍵結軌域σnb的形狀。因為CO分子左右不對稱,因此這兩個軌域的電子分布也不對稱。這種不對稱性造成CO分子化學性質與N2截然不同。例如CO吸附在過渡金屬原子上時,多半是由碳原子那端與金屬原子產生鍵結。這些性質變化,此處篇幅不足,不擬詳加敘述。
甲烷的分子軌域
甲烷的分子具四面體的結構,這個四面體可以放入一個正方體的構形中,如圖十一。如果把通過此一正方體各個面上中心點的聯線,稱為x,y,z軸,則可把Px,Py,Pz及s軌域放進此立方體中。依據軌域作用時對稱性原則,我們可作出八個分子軌域的示意圖。其中能量較低的四個為電子所占有,而其圖形顯示於圖十一下方。
這四個分子軌域最左的一個與右邊三個有明顯的不同,事實上它們的能階圖(圖十二上方)顯示最左邊的軌域能量較另三個為低。換句話說,甲烷的八個價電子並不完全相等,而是分散在兩個不等的能階之中。
這個結論猛然看來,與依價鍵理論預測的結果不一樣。價鍵理論預測碳的2s與2p混成後產生四個全等的SP3軌域,然後再由這四個軌域進一步生成四個全等的σ鍵結,而分子軌域理論提出的結果則顯示:一個低階的2s與三個高階的2p生成的四個鍵結並不全等。每個價電子皆是運轉於五個原子核之間!
實驗上測量到的數據顯示圖十二上方的能階圖是正確的。利用氣態光電子譜儀(photoelectronspectrometer)可量度甲烷所有電子的游離能,亦即每個電子所具有的位能。圖十二下方是測量到的光譜圖。此圖顯示甲烷的電子共分布在三個不同的能階上,與圖十二上方的能階圖符合。所以分子軌域理論所得的電子結構情況是比較合理的。
結論
利用分子軌域理論,可以對分子上電子分布的狀況作更精確的描述。本文中讀者可以了解到,即使是最簡單的分子如N2及CH4,我們都可獲得運用一般價鍵理論預測不到的結果。這些對電子分布的精確描述是我們欲深入討論各種化學性質所必備的知識。目前電子計算機的進步及計算軟體的日益精進,使以前所謂的「外行人」(非理論化學家,包括筆者)皆可以很方便的解出需用的分子軌域資料。只是欲成功的解讀這些資料,還須具備對分子軌域的基本概念。