基本介紹
- 中文名:冶金過程動力學
- 類型:學術科目
- 研究內容:過程的速度及其機理
- 套用領域:微觀動力學和巨觀動力學
基本簡介,相關概念,化學原理,
基本簡介
微觀動力學和巨觀動力學 冶金過程通常是在高溫、有多相存在和有流體流動下的物理化學過程。反應速度除了受溫度、壓力和化學組成及結構等因素的影響外,還受反應器(如冶金爐等)的形狀和物料的流動狀況以及熱源等因素的影響。當反應的條件發生變化時,反應進行的途徑(步驟)即反應機理也要發生變化。從分子理論微觀地研究反應速度和機理稱為微觀動力學。一般情況,物理化學中的化學動力學屬於微觀動力學的範疇;結合反應裝置在有流體流動、傳質及傳熱條件下巨觀地研究反應速度和機理稱為巨觀動力學。冶金過程動力學即屬於巨觀動力學的範疇。
反應的控制步驟 為使某一反應進行,必須將參與反應的物質傳送到反應進行的地點(界面),在那裡發生反應,並使反應產物儘快排除。其中速度最慢的步驟限制著整個反應的速度,這個最慢的步驟稱為控制步驟或限制環節。研究反應速度的目的就是要弄清在各種條件下反應進行的各種步驟,也即反應的機理,找出它的限制環節,並導出在給定條件下反應進行的速度方程式,以便用來控制和改進實際操作。
反應的控制步驟 為使某一反應進行,必須將參與反應的物質傳送到反應進行的地點(界面),在那裡發生反應,並使反應產物儘快排除。其中速度最慢的步驟限制著整個反應的速度,這個最慢的步驟稱為控制步驟或限制環節。研究反應速度的目的就是要弄清在各種條件下反應進行的各種步驟,也即反應的機理,找出它的限制環節,並導出在給定條件下反應進行的速度方程式,以便用來控制和改進實際操作。
相關概念
反應速度 通常以單位時間物質i的濃度Ci(對非理想溶液採用活度ai)的變化來表示,即反應速度表示為:
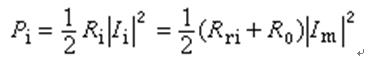
對反應物,反應速度Vi是負值;對產物則Vi為正值。
以不可逆反應aA+bB→cC+dD為例,如果體系的總體積不變,則反應物減少量和產物生成量與方程式中計量比a、b、c、d 的關係為
-dCΑ∶-dCB∶dCC∶dCD =a∶b∶c∶d
用反應物(A或B)或產物(C或D)的濃度表示的反應速度的相互關係為
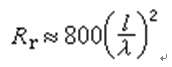
根據質量作用定律
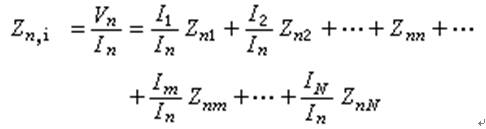
k為反應速度常數(或比反應速度),指數 (m+n)值為反應級數。反應級數與方程式的計量比一致時(即m=a,n=b),該反應稱為基元反應(elementary reaction),服從質量作用定律。但許多反應不是一步完成,或有許多副反應,因而反應級數不與方程式的計量比一致,即(m +n)/ (a+b),而其值也不一定是整數,應由實驗測得。
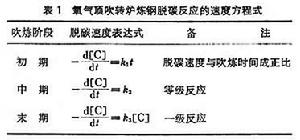
氧氣頂吹轉爐煉鋼的脫碳反應,由鋼液中的反應方程式【C】+【O】→CO來看,似應為二級反應,但實驗表明,此反應相當複雜,其反應級數隨冶煉階段而變化(表1)。由於煉鋼過程的重要反應大部分在鋼液-熔渣界面上進行,單純研究均相反應的級數,其實際意義不大。
化學原理
對於鋼液-熔渣反應,例如:鋼液中的Mn與溶渣中的FeO(Fe2+)反應:
【Mn】+(FeO)→(MnO)+【Fe】
或 【Mn】+(Fe2+)→(Mn2+)+【Fe】
其進行步驟為:
① 鋼液中Mn原子向鋼渣界面擴散移動;
② 渣中Fe2+離子向鋼渣界面擴散移動;
③ 在鋼渣界面上完成化學反應;
④ 生成的Mn2+離子從界面向渣內部擴散移動;
⑤ 生成的Fe原子從界面向鋼液內部擴散移動。
步驟③是化學反應,在高溫下反應速度很快,不可能是控制步驟。曾根據渣中含Mn2+5%、Fe2+20%,鋼液中含Mn0.2%,溫度為1600℃進行過計算(表2)。
【Mn】+(FeO)→(MnO)+【Fe】
或 【Mn】+(Fe2+)→(Mn2+)+【Fe】
其進行步驟為:
① 鋼液中Mn原子向鋼渣界面擴散移動;
② 渣中Fe2+離子向鋼渣界面擴散移動;
③ 在鋼渣界面上完成化學反應;
④ 生成的Mn2+離子從界面向渣內部擴散移動;
⑤ 生成的Fe原子從界面向鋼液內部擴散移動。
步驟③是化學反應,在高溫下反應速度很快,不可能是控制步驟。曾根據渣中含Mn2+5%、Fe2+20%,鋼液中含Mn0.2%,溫度為1600℃進行過計算(表2)。
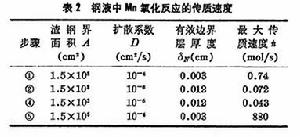
可以看出④的速度最慢,是控制步驟,它控制著[Mn]氧化入渣的整個反應。根據現有的研究成果,在煉鋼雜質去除過程中,矽、磷在鋼液中的擴散是控制步驟,而錳、硫在渣中的擴散是控制步驟。但當渣中含有大量不溶解的磷酸鈣或氧化鈣時,PO43-離子在渣中的擴散則成為磷的氧化反應的控制步驟。提高溫度降低熔體粘度或採用攪拌(機械或氣體攪拌)均可提高傳質速度。未反應核模型常用來研究氣-固反應總反應速度的模型。以鐵礦石還原為例:
Fe3O4+4CO→3Fe+4CO2
設球形試樣(如球團礦,見圖3)還原時,反應區域是由表面等速向中心推進的;反應前後,球團的體積沒有變化;固態產物是多孔的;還原氣體可以通過產物層擴散(內擴散)到反應區域。當界面的化學反應按一級反應處理時,還原總反應速度為: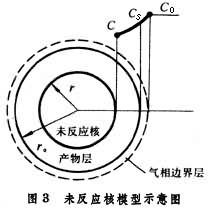
設球形試樣(如球團礦,見圖3)還原時,反應區域是由表面等速向中心推進的;反應前後,球團的體積沒有變化;固態產物是多孔的;還原氣體可以通過產物層擴散(內擴散)到反應區域。當界面的化學反應按一級反應處理時,還原總反應速度為:

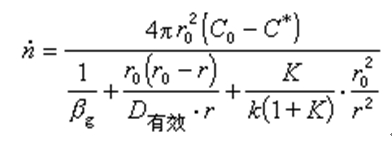
式中, ṅ 為總反應速度(摩爾/秒);r0為球團的半徑(米或厘米);r為未反應核的半徑(米或厘米);C0為氣體內部還原氣體的濃度(摩爾/米3);C*為同氣體產物相平衡的還原氣體的濃度(摩爾/米3);βg為氣體邊界層的傳質係數(米/秒或厘米/秒);K為反應的平衡常數;k為反應前進方向的速度常數(米/秒或厘米/秒);D有效為有效擴散係數(米2/秒或厘米2/秒),可按D有效=Dεξ求得,其中D為還原氣體在自由空間的擴散係數,ε是產物層的氣孔率,ξ是迷宮度係數;因為產物層中的氣孔不是直通的,而是象迷宮一樣錯綜分布,還原氣體在產物層中的擴散途徑要比直線距離長得多,所以用ξ加以修正。
總反應速度公式右邊分母第一項代表氣體邊界層的傳質阻力,第二項代表還原氣體通過固體多孔產物層的內擴散阻力,第三項代表界面化學反應的阻力。這些阻力的相對作用大小隨著礦石的種類、性質和反應條件而變化。
未反應核的半徑r是無法直接測得的,在套用該式時常用反應的轉化率或還原度f來代替:
總反應速度公式右邊分母第一項代表氣體邊界層的傳質阻力,第二項代表還原氣體通過固體多孔產物層的內擴散阻力,第三項代表界面化學反應的阻力。這些阻力的相對作用大小隨著礦石的種類、性質和反應條件而變化。
未反應核的半徑r是無法直接測得的,在套用該式時常用反應的轉化率或還原度f來代替:
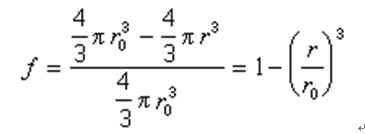
代入上列總反應式中,得
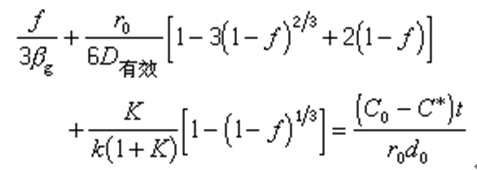
式中d0是礦石中需要還原去除的氧濃度(摩爾/米3)。利用此式可以求出欲達到某個還原度所需的時間。
冶金過程中的鐵礦石還原,石灰石焙解等都是適用未反應核模型的氣固相反應。但由於礦石顆粒本身也有孔隙度,化學反應可能在顆粒內部任何地區進行,不一定有一明確的反應區域;而且因為這些反應經常是吸熱的,需要外來熱源,伴有傳熱現象;所以全面地分析尚需要更複雜的反應模型。
冶金過程動力學的發展概況從分子理論研究反應速度的化學動力學自1850年開始,已有百餘年的歷史。套用於冶金過程的巨觀動力學自20世紀40年代末期開始發展。隨著氧氣頂吹轉爐煉鋼、連續鑄錠、閃速熔煉和噴射冶金等新技術的發展,冶金過程動力學已成為70年代以來頗為活躍的邊緣學科。除了用動力學理論及實驗方法研究冶金過程的反應速度和機理外,冶金過程動力學的另一個發展趨勢是向冶金反應工程學發展。
冶金過程動力學的發展概況從分子理論研究反應速度的化學動力學自1850年開始,已有百餘年的歷史。套用於冶金過程的巨觀動力學自20世紀40年代末期開始發展。隨著氧氣頂吹轉爐煉鋼、連續鑄錠、閃速熔煉和噴射冶金等新技術的發展,冶金過程動力學已成為70年代以來頗為活躍的邊緣學科。除了用動力學理論及實驗方法研究冶金過程的反應速度和機理外,冶金過程動力學的另一個發展趨勢是向冶金反應工程學發展。
