基本介紹
- 中文名:克當量
- 外文名: gram equivalent
- 所屬領域:核能術語
酸和鹼的克當量,酸和鹼克當量的概念,酸鹼克當量的本質 —克當量的廣義概念,計算克當量時應注意的幾個問題,複分解反應中生成水的克當量,在生成酸式鹽的反應中酸的克當量,多歩反應中化合物的克當量,氧化還原反應物質的克當量,
酸和鹼的克當量
酸和鹼克當量的概念
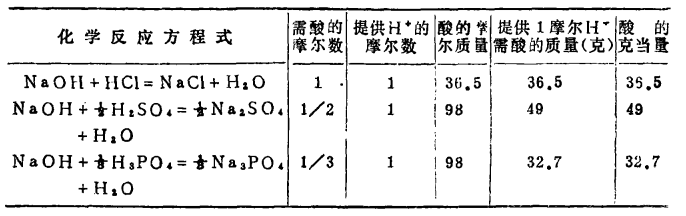
強酸強鹼中和反應的實質是:



因此1摩爾的 離子需1摩爾的
離子需1摩爾的 離子來中和。但不同的酸鹼發生中和反應時它們的質量關係又是什麼呢?為 了研究方便,先討論中和1摩爾(40克) NaOH所需幾種酸的摩爾數及其所提供離子的摩爾數和質量關係。由下表數據可知,儘管中和1摩爾(40克)NaOH所需
離子來中和。但不同的酸鹼發生中和反應時它們的質量關係又是什麼呢?為 了研究方便,先討論中和1摩爾(40克) NaOH所需幾種酸的摩爾數及其所提供離子的摩爾數和質量關係。由下表數據可知,儘管中和1摩爾(40克)NaOH所需 ,
,
 和
和 摩爾數不同,但1摩爾
摩爾數不同,但1摩爾 ,
, 摩爾
摩爾
 ,
, 摩爾
摩爾 所提供離子的摩爾數是相同的。不同的酸摩爾質量不同,提供1摩爾離子所需酸的質量也不同。我們把在化學反應中提供1摩爾
所提供離子的摩爾數是相同的。不同的酸摩爾質量不同,提供1摩爾離子所需酸的質量也不同。我們把在化學反應中提供1摩爾 離子所需酸的質量叫做該酸的克當量。例如
離子所需酸的質量叫做該酸的克當量。例如 ,
, 
 和
和 的克當量分別為36.5克,49克和32.7克。
的克當量分別為36.5克,49克和32.7克。

















同理,在化學反應中提供1摩爾離子所需的鹼的質量叫做該鹼的克當量。如 ,
, ,
, 的克當量分別為56.1克,40克,37克。
的克當量分別為56.1克,40克,37克。



分析表中酸的摩爾質量,1摩爾酸提供 離子的摩爾數及酸的克當量,三者的 關係為
離子的摩爾數及酸的克當量,三者的 關係為

酸(鹼)的克當量=酸(鹼)的摩爾質量 / 1摩爾酸(鹼)提供的 (
( )摩爾數
)摩爾數


 化學方程式表
化學方程式表酸鹼克當量的本質 —克當量的廣義概念
我們已經知道,提供1摩爾 離子所需酸的質量叫做酸的克當量。提供1摩爾
離子所需酸的質量叫做酸的克當量。提供1摩爾 離子所需鹼的質量叫做鹼的克當 量:而1摩爾
離子所需鹼的質量叫做鹼的克當 量:而1摩爾 離子和1摩爾
離子和1摩爾 離子 都帶1摩爾單位電荷。所以,我們可以說在 反應中能提供1摩爾單位電荷所需酸(鹼)的質量叫做酸(鹼)的克當量。
離子 都帶1摩爾單位電荷。所以,我們可以說在 反應中能提供1摩爾單位電荷所需酸(鹼)的質量叫做酸(鹼)的克當量。




中和反應是一種複分解反應,離子都帶有電荷,可見酸鹼克當量的概念,可推廣到複分解反應中去,即在複分解反應中,每交換摩爾單位電荷所需物質的質量就是該物質的克當量。
在氧化——還原反應中,氧化劑和還原劑發生了電子的傳遞,如:




(還原劑)(氧化劑)
所以,對氧化劑和還原劑來說,每傳遞1摩爾的電子所需氧化劑或還原劑命的質量就是它的克當量。
綜上所述,克當量的廣義概念應為交換或傳遞1摩爾單位電荷所需某物質的質量。
即克當量=物質的摩爾質量 / 1摩爾物質交換或傳遞電荷的摩爾數
這個關係式,既適用於求複分解反應 中各物質的克當量,又適用於求氧化還原反應中各物質的克當量。並且便於根據物質參加反應時的具體情況計算各物質的克當量。
計算克當量時應注意的幾個問題
當量定律指出:兩種物質總是以等克當量數進行化學反應的。實際上,不僅反應物與反 應物之間.而且反應物與生成物之間,生成物與生成物之間也都是等克當量數的。這一規律 經常被用在化學計算中,以使計算來得簡捷、準確。但是,在具體套用時,首先遇到的向題 是計算各物質的克當量。計算化合物的克當量時,大家都習慣於套用公式:化合物的克當量 =化合物的摩爾質量/化合物的正(負)價總數。而很多人在利用這個公式時,忽視了兩個 重要向題:一個是同一物質在不同的化學反應中可能表現出不同的克當量;另一個是這一計 算公式僅適合於化合物參加的基元反應。現舉例如下:
複分解反應中生成水的克當量
試看下面兩個反應:








按照上述計算化合物的克當量的公式,水的克當量應是:18/2= 9克/克當量。這樣. 在(1 )中生成1摩爾水相當於18克/9克/克當量=2克當量,從反應式中看出2克當量 CaO與2克當量HCI反應生成了 2克當量 和 2克當量水,這是符合當量定律的。
和 2克當量水,這是符合當量定律的。

但在反應(2)中,如果亦按上述公式來計算生成水的克當量,就會得出2克當量的 與2克當量HCl生成4克當量
與2克當量HCl生成4克當量 的結果,這顯然違反了當量定律,當然是不 可能的。實際上,在反應(2 )中
的結果,這顯然違反了當量定律,當然是不 可能的。實際上,在反應(2 )中 是由一個
是由一個 和一個
和一個 結合而成的,應把它按一價 化合物
結合而成的,應把它按一價 化合物 對待,即在
對待,即在 分子中,正價總數和負價總數都是一,這樣水的克當量 就應該是18克/克當量,生成水的克當量數就不是4而是2 了。
分子中,正價總數和負價總數都是一,這樣水的克當量 就應該是18克/克當量,生成水的克當量數就不是4而是2 了。







在生成酸式鹽的反應中酸的克當量
請看下面這個反應:
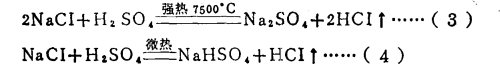 反應方程式
反應方程式可以看出,在反應(3)中,1摩爾H2SO4相當於2克當量H2SO4,而在反應(4)屮,1摩爾H2SO4相當於1克當量H2SO4,這是因為在未加熱的條件下,.生成HCI的溶解度很 大,在水中電離出的H+濃度很髙,足以抑制H2SO4的二級電離,使其只停留在一級電離階 段。故在反應(4)中硫酸的克當量不再是49克/克當量,而是98克/克當量。這樣,反應 (4 )仍然是符合當量定律的。
同理,當鹼與其它物質反應生成鹼式鹽的時候,鹼的克當量也是這樣計算的。
多歩反應中化合物的克當量





如果用計算化合物的克當量的公式直接用於這一反應,就會得出6克當量Al2( S04)3與8 克當量NaOH完全反應的結論。這當然是違背當量定律的,這是因為這一反應方程式所表示 的是一個總反應式,而總反應式只能表明反應的始態物質與終態物質之間的計量關係,而不能反映出反應所經歷的真實過程。若按反應機理把上述反應分解成連續的基元反應,則各個 基元反應都是符合當量定律的。

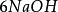










第(ii )步反應是Al(OH)3兩性性質所決定的。由於在鹼性環境中,Al(OH)3電 離、脫水、由三元鹼轉化為一元酸,所以它的克當量也隨著改變。
氧化還原反應物質的克當量
氧化還原反應昀特點是反應機理複雜,付反應多,反應速度慢,.而且隨著反應條件(溫度、濃度、催化劑、介質的性質、反應物填加次序等)的改變, 反應方式和產物也隨著改變,所以在氧化還原反應中.某一氧化劑(或還原劑)的氧化還原當量是經常改變著的,所以更應特別注意。
物質氧化還原當量E的計算公式是:
E=物質的摩爾質量/n
式中n是該物質在反應中得失電子數或氧化數的改變值。
在氧化還原反應中,氧化劑和還原劑在基元反應中也是符合當量定律的,例如反應







其中氧化劑K2Cr2O7在反應中得到6個電子n=6,因此EK2Cr2O7= 294.18/6=49.03
還原劑FeSO4在反應中失去一個電子,所以E =151.85/1=151.85
=151.85/1=151.85

生成物 的氧化還原當量應當這樣來考慮:因為一分子
的氧化還原當量應當這樣來考慮:因為一分子 有二個
有二個 原子,而這二個
原子,而這二個 原子是從
原子是從 中的二個Cr原子得到6個電子轉變而來的。所以n= 6
中的二個Cr原子得到6個電子轉變而來的。所以n= 6





E =391.90/6=65.31
=391.90/6=65.31

反應方程中其它物質(介質及其產物除外)的氧化還原當量也是同樣算法,不再詳述.。可以看出在這一方程式中 、
、 、
、 的克當量數都是6,符合當 定律。
的克當量數都是6,符合當 定律。



再舉下面兩個反應:



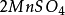


10克當量 10克當量10克當量 10克當量



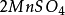


10克當量 10克當量 10克當量 2克當量 8克當量
這兩個反應的反應物和生成物都相同,只是所配係數不同。可以看出,在反應(1 ) 中, ,
, ,S的當量都數是10,.這是符合當量定律的。
,S的當量都數是10,.這是符合當量定律的。



