朗伯一比爾定律(Lambert-Beer law)是分光光度法的基本定律,是描述物質對某一波長光吸收的強弱與吸光物質的濃度及其液層厚度間的關係。
基本介紹
- 中文名:朗伯比爾定律
- 外文名:Beer-Lambert Law
- 釋義:光被透明介質吸收的比例
- 性質:物理學定理
- 套用:分光光度技術
概念
公式意義
A為吸光度,T為透射比(透光度),是出射光強度(I)比入射光強度(I0).
c為吸光物質的濃度,單位為mol/L,b為吸收層厚度,單位為
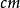

Lambert-Beer定律一般指本詞條
朗伯一比爾定律(Lambert-Beer law)是分光光度法的基本定律,是描述物質對某一波長光吸收的強弱與吸光物質的濃度及其液層厚度間的關係。
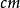
朗伯一比爾定律(Lambert-Beer law)是分光光度法的基本定律,是描述物質對某一波長光吸收的強弱與吸光物質的濃度及其液層厚度間的關係。...
Lambert-Beer定律是吸收光度法的基本定律,表示物質對某一單色光吸收的強弱與吸光物質濃度和厚度間的關係。 1.Lambert-Beer定律的推導 ⑴Lambert-Beer定律的數學...
比爾-朗伯特定律( Beer-Lambert law) 是光通過物質時被吸收的定律。它適用於所有電磁輻射和所有吸光物質;包括氣體,固體,液體,分子,原子和離子。比爾-朗伯特定律是...
比爾-朗伯定律(Beer–Lambert law),又稱比爾定律、比耳定律、朗伯-比爾定律、布格-朗伯-比爾定律(Bouguer–Lambert–Beer law),是光吸收的基本定律,適用於所有的電...
比爾-朗伯定律,也稱比爾定律,朗伯-比爾定律或Beer-Lambert-Bouguer定律。該定律將光的衰減與光傳播所通過材料的性質關聯起來,通常套用於化學分析測量,並能解釋物理...
根據煙幕消光理論,在單次散射情況下,煙幕消光服從Lambert-beer定律。分步插層法製備的膨脹石墨的尺度在毫米量級,遠大於紅外波長,因此膨脹石墨在紅外波段的消光截面受...
朗伯一比爾(Lambert - Beer)定律是分光光度法定量分析依據的基本原理。當一束單色光(指路由一種顏色的光)通過一均勻的溶液時,一部分被吸收,一部分透過。設入射...
紅外氣體感測器是一種基於不同氣體分子的近紅外光譜選擇吸收特性,利用氣體濃度與吸收強度關係(朗伯-比爾Lambert-Beer定律)鑑別)鑑別氣體組分並確定其濃度的氣體感測...
Lambert-Beer定律當我們把一束單色光(I0)照射溶液時,一部分光(I)通過溶液,而另一部分光被溶液吸收了。這種吸收是與溶液中物質的濃度和液層的厚度成正比,這就...
第一節 吸收光譜的基礎知識1.1電磁波的基本性質與分類1.2分子的能級圖1.3能級躍遷和吸收光譜1.4lambert-beer定律第二節 紫外吸收光譜的基本知識2.1分子軌道2.2...
2 朗伯-比爾定律 當紅外線波長與被測氣體吸收譜線相吻合時,紅外能量被吸收。紅外光線穿過被測氣體後的光強衰減滿足朗伯-比爾(lambert-beer)定律: 式中和分別表示...
由由Lambert-Beer定律導出組織中單態氧濃度的分布,得到在其影響下不同組織深度處光漂白速率的變化情況。3、皮膚癌自體螢光性質的研究。用顯微分光光度計(MSP觀察基...
紫外吸收檢測器簡稱紫外檢測器,是基於溶質分子吸收紫外光的原理設計的檢測器,其工作原理是Lambert-Beer定律,即當一束單色光透過流動池時,若流動相不吸收光,則吸收...
光經過待測氣體後由光纖進入光譜儀分析,吸收光譜相比於原來的背景光譜減少,根據Lambert-Beer吸收定律測量氣體的濃度。光在池體內的反射次數取決於池體長度、光程長度...
二、朗伯-比爾(Lambert-Beer)定律朗伯-比爾定律是比色分析的基本原理,這個定律是有色溶液對單色光的吸收程度與溶液及液層厚度間的定量關係。此定律是由朗伯定律和...
因此,TDLAS技術是一種高解析度的光譜吸收技術,半導體雷射穿過被測氣體的光強衰減可用朗伯-比爾(Lambert-Beer)定律表述式中,IV,0和IV 分別表示頻率V的雷射入射時和...
紫外光譜技術以朗伯一比耳(Lambert--Beer)定律為理論基礎對體系中組分進行定量分析。物質的吸光係數是各物質在一定波長的特徵常數,不同的化合物在一定波長的吸光...
藤蔓生物安卓版食品安全快速檢測綜合分析儀是根據食品中的有害物質分子對可見光的選擇性吸收和朗伯-比爾(Lambert-Beer)定律,用未知濃度樣品與已知濃度標準物質比較的...
1852年,比爾(Beer)參考了布給爾(Bouguer)在1729年和朗伯(Lambert)在1760年所發表的文章,提出了分光光度的基本定律,即液層厚度相等時,顏色的強度與呈色溶液的...
