簡介
反應機理

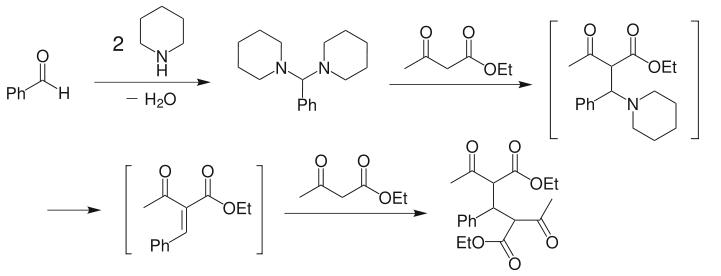
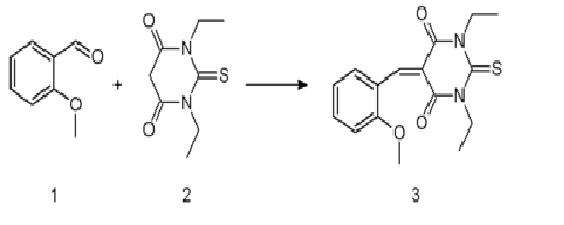
套用
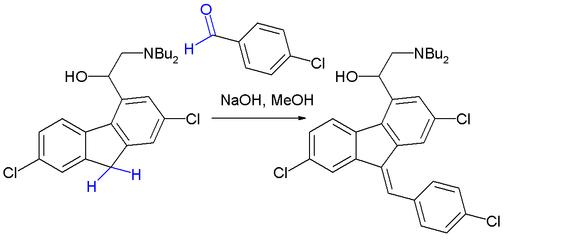






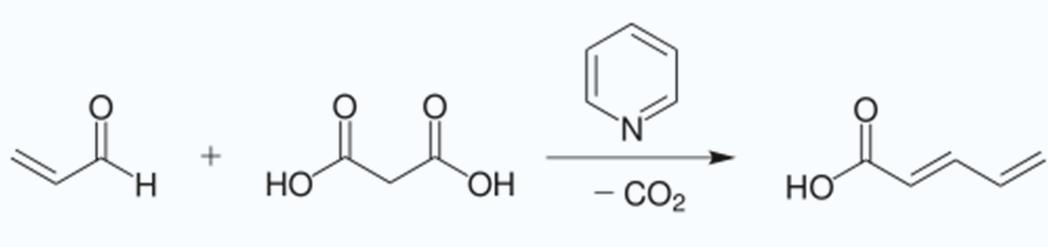
Knoevenagel反應是指醛或酮在弱鹼(胺、吡啶等)催化下,與具有活潑α-氫原子的化合物縮合的反應。
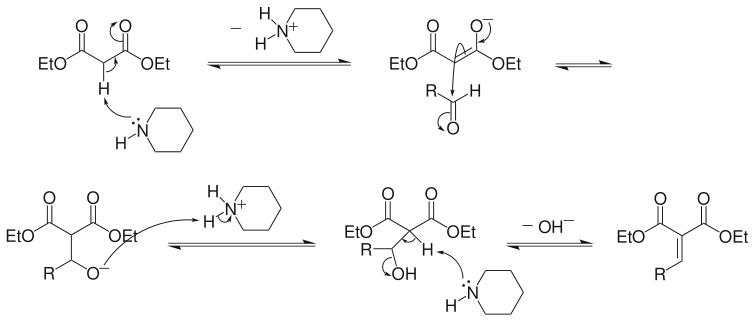
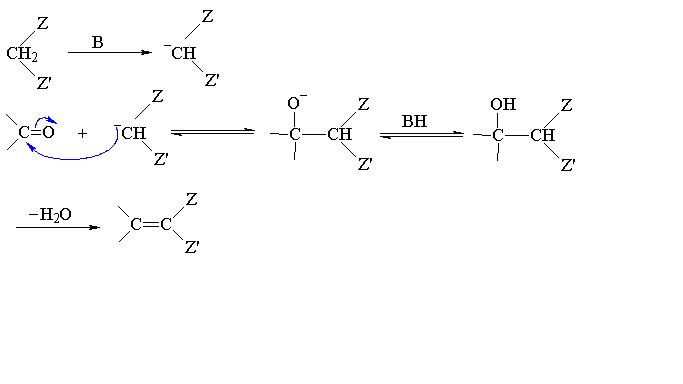
關於Knoevenagel反應的機理有多種解釋,但是人們普遍公認的有兩種。一種反應機理是羰基化合物在伯胺、仲胺或銨鹽的催化下形成亞胺過渡態,然後與活性亞甲基化合物所...
克腦文蓋爾縮合反應,Knoevenagel,是指含有活潑亞甲基的化合物與醛或酮在弱鹼催化下,發生失水縮合生成α,β-不飽和羰基化合物及其類似物。...
Perkin反應,又稱普爾金反應,由不含有α-H的芳香醛(如苯甲醛)在強鹼弱酸鹽的作用下與有機酸酐進行的縮合反應。與Knoevenagel反應一致的條件下(鹼性)、酸酐與芳香族...
羥醛縮合反應是指含有活性α氫原子的化合物如醛、酮、羧酸和酯等,在催化劑的...如:Knoevenagel反應和Darzen反應。 [2] Aldol反應常用的催化劑 編輯 ...
《縮合反應原理》是2017年化學工業出版社出版的圖書,作者是孫昌俊、王秀菊。...... 包括α-羥烷基化反應、α-鹵烷基反應...一、Knoevenagel反應170 二、Stobbe反應17...
Xia 等以水為溶劑,反應後用氯化鐵或高錳酸鉀作氧化劑,一鍋得到取代吡啶漢奇吡啶合成反應改進法 編輯 Knoevenagel–Fries改進法 將反應套用於不對稱吡啶環的合成。...
2. Perkin反應合成香豆素類化合物146 3. Knoevenagel反應合成香豆素類化合物148 4. Wittig反應合成香豆素類化合物152 5. Reformatsky反應合成香豆素類化合物153 6.以...
若催化劑是溫和的鹼,如氫氧根離子或醇負離子,則羥醛反應可通過形成共振-穩定的...其套用在亞甲基臨近於兩個羰基或者氰基的分子中較常見,如Knoevenagel縮合反應和丙...
《精細有機單元反應》是一本由高等教育出版社在2007年出版的書籍。...... 二、Knoevenagel-Doebner反應三、Darzens反應四、Claisen反應第三節 烯鍵參加的縮合反應一...
本書精選了將近490個(類)常見的有機化學反應(大多是人名反應),每個反應均給...Julia-Kocienski成烯反應52Kilani-Fischer合成52Knoevenagel縮合反應54...
《高等有機化學--反應、機理與結構》是2010年1月1日化學工業出版社出版的圖書...16 41Knoevenagel反應58716 42Peterson烯化反應58916 43活潑氫化合物與CO2和CS2...
9.5.1 醛酮縮合反應 9.5.2 芳香醛的系列固相縮合反應 9.5.3 吲哚與羰基化合物的固相縮合反應 9.5.4 狄克曼縮合反應 9.5.5 Knoevenagel縮合反應 ...
Knoevenagel反應 Wittig反應 Mannich反應 詞條圖冊 更多圖冊 詞條標籤: 科學百科化學分類 , 中國化工學會 , 非生物 , 科學, 學科 圖集...
實驗4.21皂化反應:水晶肥皂的製備 實驗4.22williamson反應:苯氧乙酸的合成 實驗4.23Knoevenagel反應:香豆素一3一羧酸的製備 實驗4.24Reimer—Tiemann反應:香草醛的...
一、鹼催化下活潑亞甲基化合物與醛 酮的縮合(Knoevenagel反應) 二、鹼催化下丁二酸酯與醛、酮的縮合(Stobbe反應) 三、Perkin反應 第四節 實例 參考文獻 第六章...
4.2.3水解反應/ 1644.2.4Knoevenagel縮合反應/ 1654.2.5烯烴環氧化反應/ 1664.2.6加成-環化反應/ 1674.3羰基金屬陰離子功能化離子液體催化烷氧羰基化反應/ 169...
