鹽鍵又叫離子鍵,離子鍵 (ionic bond)指帶相反電荷離子之間的相互作用。離子鍵屬於化學鍵,大多數的鹽,鹼,活潑金屬氧化物都有離子鍵
基本介紹
- 中文名:鹽鍵
- 外文名:ionic bond
- 別稱:離子鍵
- 分類:化學鍵
- 釋義:指帶相反電荷離子之間的相互作用
- 主要鹽鍵:NaCl、CsCl、CaF2
概述,離子鍵與離子作用,
概述
鹽鍵又稱鹽橋或離子鍵,是蛋白質分子中正、負電荷的側鏈基團互相接近,通過靜電吸引而形成的,如羧基和氨基、胍基、咪唑基等基團之間的作用力。 吸引力F與電荷電量的乘積成正比,與電荷質點間的距離平方成反比,在溶液中此吸引力隨周圍介質的介電常數增大而降低。在近中性環境中,蛋白質分子中的酸性胺基酸殘基側鏈電離後帶負電荷,而鹼性胺基酸殘基側鏈電離後帶正電荷,二者之間可形成離子鍵。鹽鍵的形成不僅是靜電吸引而且也是熵增加的過程。升高溫度時鹽橋的穩定性增加,鹽鍵因加入非極性溶劑而加強,加入鹽類而減弱.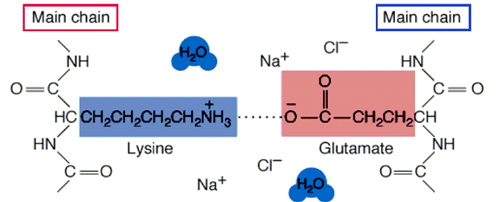

離子鍵與離子作用
鹽鍵又稱離子鍵,在中學裡學過離子鍵,以及NaCl、CsCl、CaF2、立方ZnS、六方ZnS、金紅石TiO2 這六種典型化合物的晶體構型,是強作用力。
在生物學中重點是了解有機分子的離子相互作用。有機分子形成的離子,電負性差異沒有那么大,相互作用不像這些典型的離子化合物離子鍵這樣大,所以就稱為離子相互作用;但他們的共同點都是靠靜電引力做形成。
靠靜電引力而結合形成的化合物,這種化學鍵稱為離子鍵(Ionic Bonds),一般是由電負性較小的金屬元素和半徑較大,電負性較大的非金屬元素形成的。離子晶體的結構可以歸結為不等徑圓球的密堆積問題,正負離子半徑比對離子晶體結構型式即正、負離子半徑的相對大小,直接影響到離子的堆積方式和離子晶體的結構型式。
離子的極化:離子本身帶有電荷,形成一個電場,離子在相互電場作用下,可使電荷分布的中心偏離原子核,而發生電子云變形,出現正負極的現象。離子極化的出現,使離子鍵向共價鍵過渡;所以離子鍵和共價鍵本身沒有明顯的界限。
離子鍵的強弱可以用點陣能的大小來度量,點陣能又稱晶格能或結晶能。點陣能為在0K 時,1 mol 離子化合物的正負離子由相互遠離的氣態,結合成離子晶體時所放出的能量。ΔH = U (點陣能),負值越大,表明離子鍵越強,晶體越穩定,熔點越高,硬度越大。點陣能可以根據波恩-哈勃循環設計循環來求解,也可以根據公式: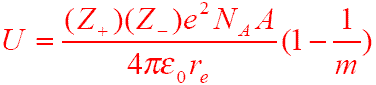
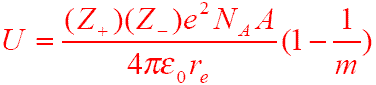
離子相互作用(Ionic Interactions)
然而這些中學的知識似乎對我們學習生物分子的離子相互作用沒有多大幫助,上面的公式顯然不能說明生物分子間離子相互作用。因為在生物分子中不是2 個電負性很大的元素來形成離子鍵(隨距離1/r 而減小),而是離子—偶極子,離子—誘導偶極子的相互作用;比如Mg2+和ATP 的相互作用,胺基酸兩性離子間的相互作用。離子—偶極子是隨1/r2 而減小,離子—誘導偶極子是隨1/r4 而減小。所以生物分子中的離子相互作用是弱相互作用,是隨1/r2—1/r4 而減小。包括離子鍵、范德華力、氫鍵、疏水作用力統稱為次級鍵;另外生物分子的識別也是依賴這些次級鍵完成的。
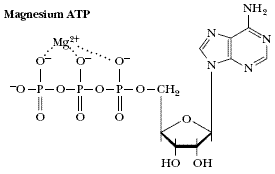 |
離子相互作用與氫鍵和共價鍵相比它沒有方向性和飽和性,因而它在生物大分子中分子中具有維持結構特異性的作用。從離子鍵的公式可以看得出離子作用和介電常數有關,所以加入非極性溶劑可以增強鹽鍵。
