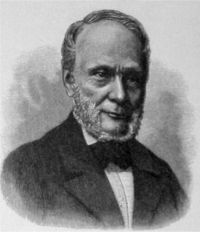簡介
魯道夫·尤利烏斯·
埃馬努埃爾·克勞修斯(Rudolf Julius Emanuel Clausius,1822年1月2日-1888年8月24日),德國物理學家和數學家,熱力學的主要奠基人之一[1]。他重新陳述了尼古拉·卡諾的定律(又被稱為
卡諾循環),把熱理論推至一個更真實更健全的基礎。他最重要的論文於1850年發表,該論文是關於熱的力學理論的,其中首次明確指出
熱力學第二定律的基本概念。他還於1865年引進了熵的概念。
學術造詣
他最重要的論文於1850年發表,該論文是關於熱的力學理論的,其中首次明確指出
熱力學第二定律的基本概念。他還於1865年引進了熵的概念。
主要經歷
1822年1月2日生於普魯士的克斯林(今波蘭科沙林)的一個知識分子家庭。1840年入
柏林大學。1847年在
哈雷大學主修數學和物理學的哲學博士學位。從1850年起,曾先後任柏林炮兵工程學院、
蘇黎世工業大學、
維爾茨堡大學、
波恩大學物理學教授。他曾被
法國科學院、
英國皇家學會和
彼得堡科學院選為院士或會員。)因發表論文《論熱的動力以及由此導出的關於熱本身的諸定律》而聞名。1855年任蘇黎世工業大學教授,1867年任德意志帝國維爾茨堡大學教授,1869年起任波恩大學教授。1865年和1868年分別當選法國科學院院士和英國皇家學會會長。
生平
克勞修斯生於
波美拉尼亞省的克斯林市,在他父親的學校開始接受教育。幾年之後,他去了
什切青市就讀文理中學,1844年從
柏林大學畢業,他在大學學習的是數學和物理,同學中有海因里希·馬格努斯(Heinrich Magnus)、約翰·彼得·狄利克雷及雅各·施泰納(Jakob Steiner),也跟
蘭克學習過歷史。1847年,他完成對地球大氣的光學研究從
哈雷大學取得了博士學位,之後當上了德國皇家炮兵工科學院的物理學教授及柏林大學的無俸講師。1855年至1867年在
蘇黎世聯邦理工學院擔任教授,其後移居至
維爾茨堡,兩年後的1869年又移居
波恩。
1870年克勞修斯在
普法戰爭中組織了一支救傷隊,在戰爭中受了傷,持久傷殘,因此被授予
鐵十字勳章。
他的妻子阿德萊德·麗姆普蘭姆(Adelheid Rimpham)於1875年難產而死,留下他獨力撫養六個孩子。但他仍繼續教學,只是從此研究時間就少了。
克勞修斯于波恩去世。
研究
克勞修斯在他關於光折射的博士論文中提出,我們白天看見藍天空,日出及日落時看見各種紅天空(以及其他一些現象),都是由光的
折射和反射導致的。以後,
瑞利勳爵提出這其實是由光的
散射所導致的,但無論如何,克勞修斯所採取的研究方法比之前的相關研究要
數學化得多。
他最有名的論文《論熱的移動力及可能由此得出的熱定律》(Über die bewegende Kraft der Wärme)於1850年發表,其中涉及到熱的力學理論。在這篇論文中,他提出了卡諾的定律與
能量守恆的概念不一致,克勞修斯重新陳述了兩條
熱力學定律以克服這個矛盾(第三定律由瓦爾特·能斯特於1906年至1912年間發表)。這篇論文使得他的科學事業開始起飛。
克勞修斯在1857年改進了奧古斯特·克羅尼格(August Krönig)非常簡單的氣體運動模型,引進了分子的平移、旋轉及振動運動,對
分子運動論領域作出了貢獻。在同一份研究中他還引進了一
粒子的平均自由徑概念。
研究成果
熱力學研究
克勞修斯主要從事
分子物理、熱力學、
蒸汽機理論、理論力學、數學等方面的研究,特別是在熱力學理論、
氣體動理論方面建樹卓著。他是歷史上第一個精確表示
熱力學定律的科學家。1850年與蘭金(William John Ma-Zquorn Rankine,1820~1872)各自獨立地表述了熱與
機械功的普遍關係──
熱力學第一定律,並且提出蒸汽機的理想的
熱力學循環(蘭金-克勞修斯循環)。1850年克勞修斯發表《論熱的動力以及由此推出的關於熱學本身的諸定律》的論文。他從熱是運動的觀點對
熱機的工作過程進行了新的研究。論文首先從
焦耳確立的
熱功當量出發,將
熱力學過程遵守的
能量守恆定律歸結為熱力學第一定律,指出在熱機作功的過程中一部分熱量被消耗了,另一部分熱量從熱物體傳到了冷物體。這兩部分熱量和所產生的功之間存在關係:。式中dQ是傳遞給物體的熱量,dW表示所作的功,U是
克勞修斯第一次引人熱力學的一個新函式,是體積和溫度的函式。後來
開爾文把U稱為物體的能量,即
熱力學系統的內能。論文的第二部分,在
卡諾定理的基礎上研究了能量的轉換和傳遞方向問題,提出了
熱力學第二定律的最著名的表述形式(克勞修斯表述):熱不能自發地從較冷的物體傳到較熱的物體。因此克勞修斯是熱力學第二定律的兩個主要奠基人(另一個是開爾文)之一。
在發現熱力學第二定律的基礎上,人們期望找到一個物理量,以建立一個普適的判據來判斷
自發過程的進行方向。克勞修斯首先找到了這樣的物理量。1854年他發表《力學的熱理論的第二定律的另一種形式》的論文,給出了可逆循環過程中熱力學第二定律的數學表示形式:,而引入了一個新的後來定名為熵的態參量。1865年他發表《力學的熱理論的主要方程之便於套用的形式》的論文,把這一新的態參量正式定名為熵。並將上述積分推廣到更一般的循環過程,得出
熱力學第二定律的數學表示形式:≤0等號對應於
可逆過程,不等號對應於
不可逆過程。這就是著名的克勞修斯不等式。利用熵這個新函式,
克勞修斯證明了:任何
孤立系統中,系統的熵的總和永遠不會減少,或者說自然界的自發過程是朝著熵增加的方向進行的。這就是“
熵增加原理”,它是利用熵的概念所表述的熱力學第二定律。後來克勞修斯不恰當地把熱力學第二定律推廣到整個宇宙,提出所謂“
熱寂說”。
氣體動理論研究
在
氣體動理論方面
克勞修斯作出了突出的貢獻。克勞修斯、麥克斯韋、
玻耳茲曼被稱為氣體動理論的三個主要奠基人。由於他們的一系列工作使氣體動理論最終成為定量的系統理論。1857年克勞修斯發表《論熱運動形式》的論文,以十分明晰的方式發展了氣體動理論的基本思想。他假定氣體中分子以同樣大小的速度向各個方向隨機地運動,氣體分子同器壁的碰撞產生了氣體的壓強,第一次推導出著名的
理想氣體壓強公式,並由此推證了
玻意耳-馬略特定律和蓋·呂薩克定律,初步顯示了氣體動理論的成就。而且第一次明確提出了物理學中的統計概念,這個新概念對
統計力學的發展起了開拓性的作用。
1858年發表《關於氣體分子的平均自由程》論文,從分析氣體分子間的相互碰撞入手,引入單位時間內所發生的碰撞次數和氣體分子的
平均自由程的重要概念,解決了根據理論計算氣體
分子運動速度很大而
氣體擴散的傳播速度很慢的矛盾,開闢了研究氣體的輸運過程的道路。
熱力學理論
熱力學理論的奠基者
克勞修斯一生研究廣泛,但最著名的成就是提出了
熱力學第二定律,成為熱力學理論的奠基人之一。人類科學發展到19世紀,蒸汽機的套用已經十分廣泛,如何進一步提高
熱機的效率問題越來越受到人們的重視,成了理淪物理研究的重點課題。1824年,卡諾在
熱質說和
永動機不可能的基礎上證明了後來著名的
卡諾定理,這不僅推論出了
熱機效率的最上限,而且也包含了熱力學第二定律的若干內容。此後,經過許多科學家長期的研究,到19世紀中葉,
能量轉化和守恆定律建立了起來,這個物理學中極其重要的普遍規律,很快就成為研究熱和其他各種運動形式相互轉化的堅實基礎。
克勞修斯從青年時代起,就決定對熱力進行理論上的研究,他認為一旦在理論上有了突破,那么提高
熱機的效率問題就可以迎刃而解。有了明確目標,
克勞修斯學習異常勤奮,他知道只有在學生階段打下堅實的數理基礎,才能在今後的研究道路上有所建樹。因此,克勞修斯用了近10年時間在學校里埋頭苦讀。有志者事竟成,1850年,克勞修斯發表了第一篇關於熱的理淪的論文——《論熱的動力以及由此推出關於熱本身的定律》。在論文裡,他首先以當時
焦耳用實驗方法所確立的
熱功當量為基礎,第一次明確提出了
熱力學第一定律:在一切由熱產生功的情況中,必有和所產生的功成正比的熱量被消耗掉;反之,消耗同樣數量的功,也就會產生同樣數量的熱。按照這個基本定律,
克勞修斯又以
理想氣體為例,進行進一步的論述,否定了熱質理論的基本前提,即宇宙中的熱量守恆,物質內部的熱量是對
氣體分子運動論的貢獻
作為熱力學理淪的奠基人,克勞修斯一生的成就遠不止於此,他在許多方面都取得了令人矚目的研究成果,尤其在氣體分子運動論方面,人們也習慣性地把他和麥克斯韋、
玻耳茲曼一起稱為分子運動論的奠基人。
氣體分子理論
早在18世紀,科學家們就發現氣體是由大量激烈運動的
粒子組成的,氣體的壓力來自於粒子對器壁的碰撞。到了19世紀50年代,
克勞修斯等建立了熱力學理論,並用熱的運動學說作為基礎來進行
分子運動研究,這大大促進了分子運動學說的發展。1857年,克勞修斯發表了一篇具有奠基性質的論文《論我們稱之為熱的那種運動》,論文內容豐富,闡述了多個有關分子運動的問題。克勞修斯從氣體是運動分子集合體的觀點出發,認為考察單個分子的運動既不可能也毫無意義,系統的巨觀性質不是取決於一個或某些分子的運動,而是取決於大量分子運動的平均值。因此,他提出了統計平均的概念,這是建立分子運動論的前提。根據這個前提,
克勞修斯建立了
理想氣體分子運動的模型,並強調
分子的動能不僅是它們的直線運動,而且是分子中原子旋轉和振盪的運動,從而正確確定了實際氣體和理想氣體的區別。在此基礎上,克勞修斯計算了碰撞器壁的
分子數和相應的分子的動量變化,並通過一系列複雜的演算和論證,最終得出了因
分子碰撞而施加給器壁的壓強公式,從而揭示了
氣體定律的微觀本質。不僅如此,克勞修斯還把目光投向了氣體的固態和液態。他論斷說:三種
聚集態中的分子都在運動,只是運動的方式有所差異而已。
在1857年的論文中,克勞修斯第一次計算得到了氧、氮、氫3種氣體分子在冰點時的速率。然而這個氣體分子運動速度高達每秒數百米的結論,遠遠超出了人們的意料,因為在現實生活中,氣體的擴散(比如煙霧的瀰漫)過程是相當的緩慢,因此人們對於
克勞修斯的研究成果表示了極大的懷疑。如何才能解釋這個根據理論計算得出的
分子運動速度,與氣體
擴散現象所顯示的速度二者之間的矛盾呢?克勞修斯陷入了新的困惑之中。他意識到,自己以前把分子看作數學幾何點的模型不夠確切,必須加以修正。他從分析氣體分子間的相互碰撞人手,把分子的作用範圍作為他依據的主要概念,引人了在單位時間內所發生的碰撞數和分子運動的自由程兩個概念,並得出了第一個子均自由程的公式。通過這些全新的研究方法,克勞修斯認為,儘管單個分子運動的速度非常快,但由於分子間的相互碰撞,分子運動的軌跡十分曲折,就整個分子的集合體而言,其前進的路程就更加漫長,遠遠小於
分子運動速度紿出的結果,這也就是
氣體擴散緩慢的原因。
克勞修斯開創性地解決了氣體擴散速度小於分子運動速度之間的矛盾,終於打消了人們心頭的疑慮,使得他們對於分子運動論充滿了信心,開闢了研究氣體運動現象的道路。
熵理論
克勞修斯在1867年發表的論文“Abhandlungen über die mechanische Wärmetheorie, Zweite Abteilung”中,首次為熵概念提供了數學版本,並為它命名,他用了現已棄用的熵單位“克勞修斯”(符號為
Cl)。
1 Cl = 1 cal/°C = 4.1868 J/K
其他貢獻
克勞修斯在其他方面貢獻也很多。他從理論上論證了焦耳-楞次定律。1851年從熱力學理論論證了克拉珀龍方程,故這個方程又稱
克拉珀龍-克勞修斯方程。1853年他發展了
溫差電現象的熱力學理論。1857年他提出電解理論。1870年他創立了統計物理中的重要定理之一──
位力定理。1879年他提出了
電介質極化的理論,由此與O.莫索提各自獨立地導出電介質的
介電常數與其
極化率之間的關係──克勞修斯-莫索提公式。
主要著作有《力學的熱理論》、《勢函式與勢》、<熱理論的第二提議》等。
獲得榮譽
學術榮譽
被銘刻的榮譽
在自然科學界和哲學界人們永久銘記克勞修斯於1865年用過的兩句名言:
“宇宙的能量是恆定的”。
“宇宙的熵趨向一個最大值”。
熵的學科延伸