基本介紹
基本概念
流動與力
定義和連續方程
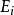
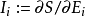
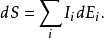
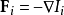
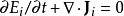
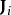
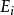
另見
- 熵 (熱力學)
- 熵 (資訊理論)
- 自組化臨界
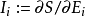
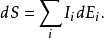
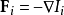
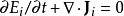
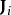
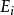
非平衡態熱力學是熱力學的一門分支,研究時變熱力學系統、不可逆轉變和開始系統。非平衡態熱力學,和平衡態熱力學相對,是研究在非零合力、流動及產生熵,但沒有...
非平衡態熱力學方法是推廣經典熱力學的研究方法,用於研究不可逆過程,又稱不可逆過程熱力學方法。長期以來,熱力學方法主要是以平衡態和可逆過程為研究對象的。經典...
《非平衡態熱力學和耗散結構》是1986年由清華大學出版社出版社出版的作品,作者是李如生。...
《非平衡態熱力學概論(第2版》是2017年清華大學出版社出版的圖書,作者是艾樹濤。...... 《非平衡態熱力學概論(第2版》是2017年清華大學出版社出版的圖書,作者是...
《平衡態和非平衡態統計熱力學 》是2007年北京世圖出版社出版的圖書,作者是Michel Le Bellac。...
《線性和非線性非平衡態熱力學進展和套用》是2006年6月化學工業出版社出版的圖書,作者是彭少方、張昭。...
《非平衡態熱力學和流體力學形式邏輯分析》是2013-1出版的圖書,作者是楊本洛。...... 《非平衡態熱力學和流體力學形式邏輯分析》是2013-1出版的圖書,作者是楊本洛...
平衡態熱力學方法又稱經典熱力學方法。是從能量觀點出發,研究巨觀平衡系統的性質,並建立平衡的一般規律的方法。它研究平衡系統的有序穩定結構,以及從一個平衡狀態...
系統中狀態變數不是常量的定常狀態。定常狀態指系統從初始狀態開始隨時間演進而進入的終態。非平衡態就是除平衡態以外的定常狀態,包括周期運動狀態(即振盪態)、...
《統計力學——非平衡態熱力學的隨機方法(第二版)(英文影印版)》是2014年出版的圖書,作者是斯特里特。...
由於對大氣的熱力學作用和熱力過程了解還不夠,大氣非平衡態熱力學理論研究也處在初創期,任重而道遠。1970年代以來,已嘗試從熱力熵理論來建立氣候系統模式,這樣有...
非平衡有序結構是指一個遠離半衡的開放系統,在不斷與外界交換物質和能量的過程中,通過內部非線性動力學機理,自動從無序狀態形成並維持的在時間上、空間上或功能...
