分子和分子或離子間的作用力(定向力、誘導力、色散力),以及由此而產生的沒有方向性和飽和性的作用力,叫做非專屬作用力。它們包括:離子偶極力,偶極偶極力、偶極誘導偶極力,瞬時偶極誘導偶極力。人們經常用極性來概括表示這些作用力。從廣義上來講,離子偶極力屬於分子間力。
基本介紹
- 中文名:離子偶極力
- 外文名:ion-dipole forces
- 類型:分子間力
- 套用學科:有機化學
基本信息,相關擴展,
基本信息
庫侖力即靜電吸引力,它包括離子離子力和離子偶極力。電荷分布不對稱的電中性分子具有永久偶極矩μ。對於這種偶極分子,如果用q表示電量相等的兩個相反電荷,而用d表示它們分開的距離,則偶極矩μ=qd。當將這種偶極置於某種離子所產生的電場中時,偶極本身會發生定向,吸引端(此端的電荷與離子電荷相反)將向著離子,而排斥端將背著離子。這種離子與偶極間相互作用的勢能如下圖所示:
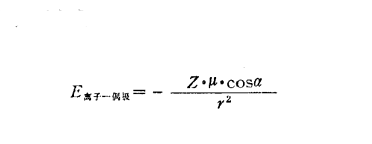 離子偶極力作用勢能
離子偶極力作用勢能Z為離子的電荷,r為由離子至偶極中心的距離,α為偶極相對於離子與偶極中心連線r的夾角。若α=0,則cosα=1。這時離子和被分開的偶極電荷都在同一直線上 ,並以此方式使偶極處於與離子緊緊相鄰的狀態。
離子偶極力對於離子化合物在極性溶劑中形成的溶液具有重要意義,在此溶液中存在著諸如Na(OH2)m+和Cl(H2O)n-一類的溶劑化質點(NaCl在H2O中形成的溶液)。有些金屬離子其溶劑化質點可能十分穩定,因而可視為獨立的質點,例如[Co(NH3)6]3+。
只有具有永久偶極矩的分子才能稱為偶極分子。除己烷、環己烷和苯等少數幾種烴類以及二硫化碳、四氯化碳和四氯乙烯等一些對稱性的化合物外,所有常用的有機溶劑都具有永久偶極矩。
相關擴展
1、偶極偶極力
由於電荷分布不對稱而具有永久偶極矩μ的各種分子,其定向力取決於分子之間的靜電作用。當距離為r的兩個偶極分子彼此取得最佳定向時,如圖(a),則其間的吸引力與1/r3成正比。另一種排列如圖(b)所示,兩個偶極分子反向平行措列。
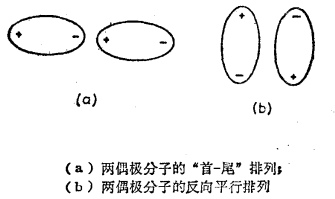 排列方式
排列方式如果偶極分子的體積不很大,第二種排列就較為穩定,只有當吸引能大於熱能時才有這兩種情況存在。因而,熱能通常會阻止偶極取得最佳的定向。如果各種可能定向的幾率均等,則吸引作用和排斥作用將互相補償。事實上導致吸引作用的偶極定向作用,在統計學上是有利的,結果產生一種淨的吸引作用,並且與溫度有著很大的關係。
2、偶極誘導偶極力
有永久偶極矩μ的分子,其電偶極能誘導鄰近分子產生偶極矩。這種誘導偶極矩總是順著誘導偶極的方向。因此,兩個匹配分子之間總有吸引力存在,這與溫度無關。受永久偶極誘導的非偶極分子,其極化度愈大,誘導偶極矩就愈大。同樣,把一種帶電的質點(例如某種離子)置於不帶電荷的非極性分子的鄰近,亦將以同樣方式使該分子的電子云發生變形。中性分子的極化取決於它固有的極化度a並與帶Z電荷的離子所提供的極化場有關。
