血紅蛋白又稱血色素,是紅細胞的主要組成部分,能與氧結合,運輸氧和二氧化碳。血紅蛋白含量能很好地反映貧血程度。
基本介紹
- 中文名:血紅蛋白
- 外文名:Hemoglobin
- 縮寫:HB,HGB
- 化學式:C3032H4816O812N780S8Fe4
正常範圍
臨床意義
Hb分子結構簡介

血紅蛋白又稱血色素,是紅細胞的主要組成部分,能與氧結合,運輸氧和二氧化碳。血紅蛋白含量能很好地反映貧血程度。

血紅蛋白又稱血色素,是紅細胞的主要組成部分,能與氧結合,運輸氧和二氧化碳。血紅蛋白(Hb)臨床意義 編輯 血紅蛋白增高、降低的臨床意義基本和紅細胞計數的臨床意義...
血紅蛋白英文縮寫為HGB或Hb。血紅蛋白是紅細胞內運輸氧的特殊蛋白質,是使血液呈紅色的蛋白,由珠蛋白和血紅素組成,其珠蛋白部分是由兩對不同的珠蛋白鏈(α鏈和β...
血紅蛋白病(hemoglobinopathy)是由於血紅蛋白分子結構異常(異常血紅蛋白病),或珠蛋白肽鏈合成速率異常(珠蛋白生成障礙性貧血,又稱海洋性貧血)所引起的一組遺傳性血液...
血紅蛋白(Hb)測定是醫院體檢的一項常規檢查項目,通常通過血液檢查的手段來進行測定,臨床上用來鑑別貧血類型。...
血紅蛋白濃度指單位體積(L)血液內所含血紅蛋白的量。血紅蛋白又稱血色素,為一種含色素的結合蛋白質,是紅細胞主要成分,能與氧結合,運輸氧和二氧化碳。血紅蛋白是由...
平均血紅蛋白濃度是指血液通過離心後僅獲取的剩下紅細胞中血紅蛋白的比例。平均紅細胞體積(MCV)測試,平均紅細胞血紅蛋白含量(MCH),平均紅細胞血紅蛋白濃度(MCHC)三...
血紅蛋白(Hb)是人體內負責運載氧的一種蛋白質,也是人體紅細胞的主要蛋白質。血紅蛋白病是一組由於珠蛋白肽鏈(α、β、γ、δ)的結構異常或合成肽鏈速率的改變,...
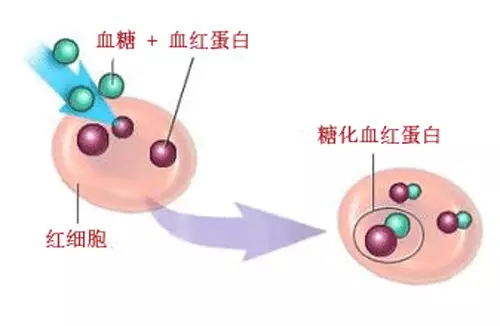
糖化血紅蛋白(GHb)是紅細胞中的血紅蛋白與血清中的糖類相結合的產物。它是通過緩慢、持續及不可逆的糖化反應形成,其含量的多少取決於血糖濃度以及血糖與血紅蛋白接觸...
血紅蛋白病是指因血紅蛋白中的珠蛋白基因發生突變,使珠蛋白合成的量或質出現...貧血的血紅蛋白(Hb)正常或輕度下降;HbH病患者Hb在70~100g/L;Hb Bart胎兒...
血紅蛋白F(hemoglobin F,HbF)鹼變性試驗(alkali denaturation test) ,即胎兒血紅蛋白(fetal hemoglobin,HbF),又稱抗鹼血紅蛋蛋白(alkali-resistant hemoglobin),具有...
異常血紅蛋白 abnormal h(a)emogloin 指血紅蛋白分子的化學結構或生物合成的異常,是由於異常的基因型而產生的,往往導致溶血性貧血等臨床症狀.。...
CO-Hb 性質 無色氣體 一氧化碳血紅蛋白carboxy-hemoglobin 血紅蛋白與一氧化碳(CO)的結合物。與氧合血紅蛋白相同,Fe原子為2價,與CO、卟啉的4個N、血球朊航的...
近年來糖化血紅蛋白(HbA1c)正日益受到臨床的高度重視,糖化血紅蛋白(HbA1c)是血紅蛋白A組分的某些特殊分子部位和葡萄糖經過緩慢而不可逆的非酶促反應結合而形成的,...
珠蛋白有4條多肽鏈,每條多肽鏈與1個血紅素相連線,構成Hb的單體或亞單位。Hb是由4個單體構成的四聚體。[1] 血紅蛋白是高等生物體內負責運載氧的一種蛋白質。...
測定糖化血紅蛋白有4種方法,比色(濁)法、層析法、電泳法和放射免疫法。免疫比濁測定方法是測定糖化血紅蛋白的A1C組分(HbA1C)。標本需用溶血素溶解血細胞後測定。...
血常規檢查包括有紅細胞計數(RBC)、血紅蛋白(Hb)、白細胞(WBC)、白細胞分類計數及血小板(PLT)等,通常可分為三大系統,即紅細胞系統、白細胞系統和血小板系統。 ...
血氧飽和度(SpO2)是血液中被氧結合的氧合血紅蛋白(HbO2)的容量占全部可結合的血紅蛋白(Hb,hemoglobin)容量的百分比,即血液中血氧的濃度,它是呼吸循環的重要生理...
血紅蛋白 Hb110~160g/L如果這些指標發生異常變化,人體就可能患病。血常規化驗作用 編輯 例如,有人每升血液中的血紅蛋白含量明顯低於正常範圍,可診斷此人可能患有...
貧血症是由於身體無法製造足夠的血紅蛋白(一種將氧氣輸送到血紅細胞和身體各個組織的蛋白質)造成的。當這種情況發生的時候,一個人會覺得乏力和感覺筋疲力盡、心情...
貧血(anemia)是指人體外周血紅細胞容量減少,低於正常範圍下限的一種常見的臨床症狀。由於紅細胞容量測定較複雜,臨床上常以血紅蛋白(Hb)濃度來代替。我國血液病學家...
