芳香過渡態理論
與基態分子一樣,周環反應的過渡態也可分為芳香性的和反芳香性的。芳香性的過渡態具有較低的活化能,若反應能夠形成芳香性過渡態,則反應是允許的。反芳香性過渡態具有較高的活化能,若反應形成反芳香性過渡態,反應將是不利的或禁阻的。
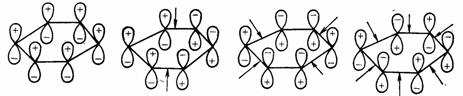
當了解了相互作用軌道的排列方式及其所涉及的電子數後,在判斷相應的過渡態是芳香性的還是反芳香性時,有兩種概念:休克爾(Hückel)軌道體系和莫比烏斯(Mobius)軌道體系的概念。對於環狀共軛多烯,休克爾軌道體系和莫比烏斯體系是不同的。
環狀共軛多烯的π軌道,在基態時位相可以發生扭轉,扭轉1、3、5、…奇數次的叫莫比烏斯體系,扭轉2、4、6、…偶數次的叫休克爾體系。例如,已知苯的分子軌道分別有0、2、4、6轉化記號,是休克爾體系,
而莫比烏斯體系
對於休克爾體系,含有4n+2個電子時是芳香性的(穩定的),含有4n個電子時是反芳香性(不穩定的);就莫比烏斯體系而言,雖然在周環反應的環狀過渡態中發現了這種扭轉體系,但實際上並未找到這種結構的分子。莫比烏斯體系的分子軌道是指環狀過渡態位相顛倒奇數次,最常見的是一次,莫比烏斯軌道理論斷言:含有個4n電子時是芳香性的(穩定的),而含有4n+2個電子時是反芳香性的(不穩定的)。
利用休克爾和莫比烏斯體系及其所規定的芳香性的概念,對周環反應選擇規律進行解釋的理論,叫“芳香性過渡態”理論。
對於周環反應,使用芳香性過渡態概念時,需要知道相鄰原子軌道的轉化記號數目和軌道所包含的電子數目。
按照芳香性過渡態概念,對於周環反應,若能形成芳香性過渡態(休克爾體系含有4n+2個電子,莫比烏斯體系含有4n個電子),反應在加熱下即可進行。因為這樣的過渡態具有較小的能量。若反應通過反芳香性過渡態(休克爾體系含有4n個電子,莫比烏斯體系含有4n+2個電子),則需在光的作用下才能進行。因為在光化學反應中,將激發態的反應物轉變成基態的產物起著決定的作用。對於反芳香性過渡態,激發態和基態之間的能量差較小,因此比較容易進行。
套用
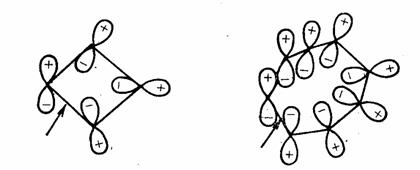
1,3-戊二烯氫原子的[1,5] σ移位有兩種可能的立體化學途徑,同面和異面過程的過渡態分別如下:
同面移位的過渡態沒有轉化記號,是休克爾體系,而異面過程的過渡態有一個轉化記號(箭頭處),是莫比烏斯體系。已知參與反應的電子數是4n+2時,休克爾體系是芳香性的,而參與反應的電子數是4n時,莫比烏斯體系是芳香性的。在此過渡態中有6個電子,屬於休克爾芳香體系,所以同面過程是允許的。
同面過程 休克爾體系 異面過程 莫比烏斯體系
在氫原子的[1,5]σ移位反應中,由於同面過程形成了芳香性過渡態,故在加熱下即可完成。而異面過程因形成反芳香性過渡態,故需在光照下才能完成。
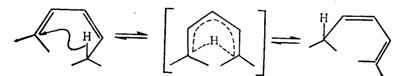
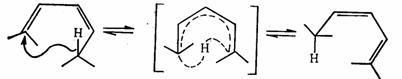
對於1,3 –丁二烯和環丁烯的相互轉化,套用芳香性過渡態理論可作如下分析:這是涉及4電子的π體系或π-σ體系,順旋是符合莫比烏斯體系 ,4個電子有一次記號轉化,是芳香性的。對旋有兩次記號轉化,是休克爾體系,但有4個電子,是反芳香性的。所以順旋能量上是有利的,反應是允許的,而對旋是禁阻的,則需在光的作用下反應才能進行。
順旋 對旋
1,3 –丁二烯的電環化反應
也可以這樣看,旋轉後休克爾體系中,分子軌道節點數為零或偶數個,而莫比烏斯體系為奇數個。
芳香性過渡態理論並不需要考慮軌道的對稱性,這是它的方便之處。