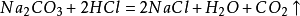簡介,物理性質,性狀,溶解性,化學性質,穩定性,熱力學函式,水解反應,與酸反應,與鹼反應,與鹽反應,蘇打四兄弟,蘇打,小蘇打,大蘇打,臭蘇打,生產方法,實驗室方法,呂布蘭法,索氏制鹼法,侯氏制鹼法,技術指標,用途,危害,健康危害,使用須知,毒理學資料,燃爆危險,急救措施,消防措施,泄漏應急處理,注意事項,儲存注意事項,運輸注意事項,教育要點,國中階段,高中階段,
簡介
在人工合成純鹼之前,古代就發現某些海藻晾曬後,燒成的灰燼中含有鹼類,用熱水浸取、濾清後可得褐色鹼液用於洗滌。大量的天然鹼來自礦物,以地下埋藏或鹼水湖為主。以沉積層存在的天然鹼礦品位最高,分布甚廣。最早發明人工合成純鹼方法是18世紀末,法國路布蘭用芒硝加石灰石和煤在高溫下還原並進行碳酸化,得到以含Na2CO3為主的粗製品-黑灰,經過浸取、蒸發、精製、再結晶、烘乾,獲得純度約為97%的重質純鹼。1861年,比利時E.索爾維獨自發明了純鹼並獲得過專利。由於技術秘密保護一直未能大範圍套用,20世紀20年代才從美國突破,尤其是中國著名的化工專家侯德榜於1932年出版了《純鹼製造》一書,將保密70年,索爾維法公布於世。侯德榜還與1939-1942創建了侯氏制鹼法,並在 四川建立了中試車間。1952年在大連化工廠設立了聯合制鹼車間。日本旭硝子公司推出的NA法,實質上是聯鹼和氨鹼的折中法。可隨意調節純鹼與氯化銨的比例。
物理性質
性狀
碳酸鈉常溫下為白色無氣味的粉末或顆粒。有吸水性,露置空氣中逐漸吸收 1mol/L水分(約=15%)。其水合物有Na2CO3·H2O,Na2CO3·7H2O和Na2CO3·10H2O。
溶解性
碳酸鈉易溶於水和甘油。20℃時每一百克水能溶解20克碳酸鈉,35.4℃時溶解度最大,100克水中可溶解49.7克碳酸鈉,微溶於
無水乙醇,難溶於
丙醇。
溶液顯鹼性,能使酚酞變紅。
化學性質
碳酸鈉的水溶液呈強鹼性(pH=11.6)且有一定的腐蝕性,能與酸發生複分解反應,也能與一些鈣鹽、鋇鹽發生複分解反應。含有結晶水的碳酸鈉有3種:Na2CO3·H2O、Na2CO3·7H2O 和 Na2CO3·10H2O。
穩定性
穩定性較強,但高溫下也可分解,生成
氧化鈉和二氧化碳:
長期暴露在空氣中能吸收空氣中的水分及二氧化碳,生成
碳酸氫鈉,並結成硬塊:
碳酸鈉的結晶水合物
石鹼(Na
2CO
3·10H
2O)在乾燥的空氣中易
風化:
熱力學函式
在(298.15K,100k)的熱力學函式:
狀態:s
標準
摩爾生成熱ΔfHmθ(kJ·mol
-1):-1130.8
標準摩爾生成
吉布斯自由能ΔfGmθ(kJ·mol
-1):-1048.1
標準熵Smθ(J·mol-1·K-1):138.8
水解反應
由於碳酸根可以結合水中的質子(即氫離子)生成碳酸氫根和
碳酸,並且能結合酸中的質子釋放二氧化碳。所以碳酸鈉在
酸鹼質子理論中屬於布朗斯特鹼。
與酸反應
以鹽酸為例。當鹽酸足量時,生成
氯化鈉和
碳酸,不穩定的碳酸立刻分
解成二氧化碳和水。這個反應可以用來製備二氧化碳:
總的化學方程式是:
當鹽酸少量時發生如下反應:
碳酸鈉與其他種類的酸也能發生類似的反應。
與鹼反應
與鹽反應
碳酸鈉能和鈣鹽、鋇鹽等發生複分解反應,生成沉澱和新的鈉鹽:
由於碳酸鈉在水中水解生成氫氧化鈉和碳酸,它與某些鹽的反應則會推動化學平衡向正方向移動,生成相應的鹼和二氧化碳:
蘇打四兄弟
蘇打
蘇打是Soda的音譯,化學式為Na2CO3。它的名字頗多,學名叫碳酸鈉,俗名除叫蘇打外,又稱純鹼或蘇打粉。帶有結晶水的叫水合碳酸鈉,有一水碳酸鈉(Na2CO3·H2O)、七水碳酸鈉(Na2CO3·7H2O)和十水碳酸鈉(Na2CO3·10H2O)三種。十水碳酸鈉又叫洗濯蘇打、洗濯鹼或晶鹼。其其他性質詳見本詞條的其他部分。
在三種蘇打中,碳酸鈉的用途最廣。它是一種十分重要的化工產品,是玻璃、肥皂、紡織、造紙、製革等工業的重要原料。冶金工業以及淨化水也都用到它。它還可用於其他鈉化合物的製造。早在十八世紀,它就和硫酸、鹽酸、硝酸、燒鹼並列為基礎化工原料--三酸兩鹼之一。在日常生活中,蘇打也有很多用途,比如它可以直接作為洗滌劑使用,在蒸饅頭時加一些蘇打,可以中和發酵過程中產生的酸性物質。
小蘇打
小蘇打的化學式是NaHCO
3。它的名字也有很多,學名
碳酸氫鈉,又稱重碳酸鈉或酸式碳酸鈉。俗名除小蘇打外,還有焙燒蘇打、發酵蘇打和重鹼等。
小蘇打是白色晶體,溶於水,水溶液呈弱鹼性。
 小蘇打(碳酸氫鈉)
小蘇打(碳酸氫鈉)在熱空氣中,它能緩慢分解,放出一部分二氧化碳;加熱至270℃時全部分解放出二氧化碳:
它也能與酸(如鹽酸)作用放出二氧化碳:
小蘇打的這些性質,使它在生產和生活中有許多重要的用途。在滅火器里,它是產生二氧化碳的原料之一;在食品工業上,它是發酵粉的一種主要原料;在製造清涼飲料時,它也是常用的一種原料;在醫療上,它是治療胃酸過多的一種藥劑。
大蘇打
大蘇打是
硫代硫酸鈉的俗名,又叫
海波(Hypo的音譯),帶有五個結晶水(Na
2S
2O
3·5H
2O),故也叫做
五水硫代硫酸鈉。
大蘇打是無色透明的晶體,易溶於水,水溶液顯弱鹼性。它在33℃以上的乾燥空氣中風化而失去結晶水。
 大蘇打(硫代硫酸鈉)
大蘇打(硫代硫酸鈉)在中性、鹼性溶液中較穩定,在酸性溶液中會迅速分解:
大蘇打具有很強的絡合能力,能跟溴化銀形成絡合物。反應式:大
根據這一性質,它可以作定影劑。洗相時,過量的大蘇打跟底片上未感光部分的溴化銀反應,轉化為可溶的Na
3[Ag(S
2O
3)
2],把AgBr除掉,使顯影部分固定下來。
大蘇打還具有較強的還原性,能將氯氣等物質還原:
所以,它可以作為綿織物漂白後的脫氯劑。類似的道理,織物上的碘漬也可用它除去。另外,大蘇打還用於鞣製皮革、電鍍以及由礦石中提取銀等。
從上面的介紹可知,“三姐妹”的名字雖然只有一字之差,但它們的性質和用途卻又如此不同。在使用它們時,要名實統一,避免張冠李戴。
臭蘇打
以上三種是較常見常用的三種蘇打。除此之外有時”臭蘇打“會提及進來。
”臭蘇打“是硫化鈉的俗名,又稱臭鹼、黃鹼、硫化鹼,具有臭味。溶解於冷水,極易溶於熱水,微溶於
醇。
工業品一般是形不同結晶水的混和物,又含有不同程度的雜質,除外觀色澤不同外,密度、熔點、沸點等亦因雜質影響而各異。
 硫化鈉
硫化鈉硫化鈉為無機化合物,純硫化鈉為無色結晶粉末。吸潮性強,易溶於水。水溶液呈強鹼性反應。觸及皮膚和毛髮時會造成灼傷。故硫化鈉俗稱硫化鹼。
硫化鈉受撞擊或者急劇加熱可能發生爆炸,化學性質不穩定,遇酸會放出有毒的硫化氫氣體:
硫化鈉能用於染料工業中生產硫化染料,是硫化青和硫化藍的原料。印染工業用作溶解硫化染料的助染劑。製革工業中用於水解使生皮脫毛,造紙工業用作紙張的蒸煮劑。還可用於紡織工業中棉織物染色的媒染劑、製藥工業用於生產解熱藥。硫化鈉還可用於直接電鍍中導電層的處理,通過硫化鈉與鈀反應生成膠體硫化鈀來達到在非金屬表面形成良好導電層的目的。
生產方法
實驗室方法
呂布蘭法
最早在1791年,古人就開始用食鹽、硫酸、
煤、石灰石為原料生產碳酸鈉,是為
呂布蘭法。
此法原料利用不充分、勞動條件惡劣、產品質量不佳,逐漸為索爾維法代替。
索氏制鹼法
1859年,比利時人
索爾維,用食鹽、
氨水、二氧化碳為原料,於室溫下從溶液中析出
碳酸氫鈉,將它加熱,即分解為碳酸鈉,人們將此方法稱為索氏制鹼法,此法一直沿用至今:
氨氣與水和二氧化碳反應生成一分子的
碳酸氫銨,這是第一步:
第二步是:碳酸氫銨與
氯化鈉反應生成的
碳酸氫鈉沉澱和氯化銨,碳酸氫鈉之所以沉澱是因為它的溶解度較小。經過濾得到碳酸氫鈉固體:
這兩步總的化學方程式是:
第三步:加熱分解碳酸氫鈉,生成水、二氧化碳和碳酸鈉即我們要的純鹼:
侯氏制鹼法
1943年中國人
侯德榜留學海外歸來,他結合中國內地缺鹽的國情 ,對索爾維法進行改進,將純鹼和合成氨兩大工業聯合,同時生產碳酸鈉和化肥
氯化銨,大大地提高了食鹽利用率,是為
侯氏制鹼法:
第一步,氨氣與水和二氧化碳反應生成一分子的
碳酸氫銨,第二步碳酸氫銨與
氯化鈉反應生成的
碳酸氫鈉沉澱和氯化銨,碳酸氫鈉之所以沉澱是因為它的溶解度較小。經過濾得到碳酸氫鈉固體。(這兩步和上面的索氏制鹼法相同)。
第三步,合成的碳酸氫鈉部分可以直接出廠銷售,其餘的碳酸氫鈉會被加熱分解,生成碳酸鈉,生成的二氧化碳可以重新回到第一步循環利用。
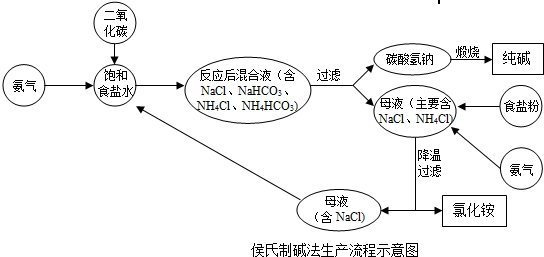 侯氏制鹼法生產流程
侯氏制鹼法生產流程根據NH4Cl溶解度比NaCl大,而在低溫下卻比NaCl溶解度小的原理,在 278K~283K(5 ℃~10 ℃) 時,向母液中加入食鹽細粉,而使NH4Cl單獨結晶析出供做氮肥。
索氏制鹼法和侯氏制鹼法所不同的,是索氏法在整個製取過程中NH3是循環使用的,而侯氏法在整個製取過程中,CO2被循環利用,NH4Cl直接作為純鹼的副產品----肥料。所以,索氏法的產品是碳酸鈉,副產氯化鈣;而侯氏法的產品是碳酸鈉,副產氯化銨。
此法優點:保留了氨鹼法的優點,消除了它的缺點,使食鹽的利用率提高到96 %;NH4Cl 可做氮肥;可與合成氨廠聯合,使合成氨的原料氣CO 轉化成CO2,革除了CaCO3制CO2這一工序。
技術指標
| 指標項目 | 指 標 |
|---|
| 1類 | 2類 | 3類 |
總鹼量(%) | 99 | 98 | 96 |
| 0.5 | 0.9 | 1.2 |
| 0.04 | 0.1 | 0.15 |
鐵(%) | 0.004 | 0.006 | 0.010 |
| 0.03 | 0.08 | - |
| 0.8 | 1.0 | 1.3 |
用途
碳酸鈉是重要的化工原料之一,廣泛套用於輕工日化、建材、化學工業、食品工業、冶金、紡織、石油、國防、醫藥等領域, 用作製造其他化學品的原料、清洗劑、洗滌劑,也用於照相術和分析領域。其次是冶金、紡織、石油、國防、醫藥及其它工業。玻璃工業是純鹼的最大消費部門,每噸玻璃消耗純鹼0.2噸。在工業用純鹼中,主要是輕工、建材、化學工業,約占2/3:其次是冶金、紡織、石油、國防、醫藥及其他工業。
玻璃工業是純鹼的攝大消費部門,每噸玻璃消耗純鹼0.2t。主要用於浮法玻璃、顯像管玻殼、光學玻璃等。
也可用於化工、冶金等其他部門。使用重質純鹼可以減少鹼塵飛揚、降低原料消耗、改善勞動條件,還可提高產品質量,同時減輕鹼粉對耐火材料的侵蝕作用,延長窯爐的使用壽命。
作緩衝劑、中和劑和麵團改良劑,可用於糕點和面制食品,按生產需要適量使用。
作為洗滌劑用於羊毛漂洗,浴鹽和醫藥用,鞣革中的鹼劑。
用於食品工業,作中和劑、膨鬆劑,如製造胺基酸、醬油和面制食品如饅頭、麵包等。還可配成鹼水加入麵食中,增加彈性和延展性。碳酸鈉還可以用於生產味素
彩電專用試劑
用於製藥工業,作解酸藥、滲透性輕瀉劑。
無水碳酸鈉用於化學及電化學除油、化學鍍銅、鋁的浸蝕、鋁及合金的電解拋光、鋁的化學氧化、磷化後的封閉、工序間的防鏽、電解退除鉻鍍層和退除鉻的氧化膜等,亦用於預鍍銅、鍍鋼、鍍鋼鐵合金電解液中
冶金工業用作冶煉助熔劑、選礦用浮選劑,煉鋼和煉銻用作脫硫劑。
印染工業用作軟水劑。
製革工業用於原料皮的脫脂、中和鉻鞣革和提高鉻鞣液鹼度。
定量分析中標定酸液的基準。測定鋁、硫、銅、鉛和鋅。檢驗尿液和全血葡萄糖。分析水泥中二氧化矽的助溶劑。金屬金相分析等
危害
健康危害
該品具有弱
刺激性和弱
腐蝕性。直接接觸可引起皮膚和眼灼傷。生產中吸入其粉塵和煙霧可引起呼吸道刺激和
結膜炎,還可有鼻黏膜潰瘍、萎縮及
鼻中隔穿孔。長時間接觸該品溶液可發生濕疹、
皮炎、雞眼狀潰瘍和
皮膚鬆弛。接觸該品的作業工人呼吸器官疾病發病率升高。誤服可造成消化道灼傷、黏膜糜爛、出血和
休克。
使用須知
毒理學資料
LC50:2300mg/m3,2小時(大鼠吸入)
燃爆危險
急救措施
皮膚接觸:立即脫去污染的衣著,用大量流動清水沖洗至少15分鐘。就醫。
(在實驗裡,不小心沾到了鹼液的時候,我們要用較多的水去沖洗,然後再塗上
硼酸溶液來進行反應)
眼睛接觸:立即提起眼瞼,用大量流動清水或生理鹽水徹底沖洗至少15分鐘。就醫。
吸入:脫離現場至空氣新鮮處。如呼吸困難,給輸氧。就醫。
食入:用水漱口,給飲牛奶或蛋清。就醫。
消防措施
危險特性:具有腐蝕性。未有特殊的燃燒爆炸特性。
有害燃燒產物:自然分解產物未知。
滅火方法:消防人員必須穿全身耐酸鹼消防服。滅火時儘可能將容器從火場移至空曠處。
泄漏應急處理
隔離泄漏污染區,限制出入。建議應急處理人員戴防塵面具(全面罩),穿防毒服。避免揚塵,小心掃起,置於袋中轉移至安全場所。若大量泄漏,用
塑膠布、
帆布覆蓋。收集回收或運至廢物處理場所處置。
注意事項
密閉操作,加強通風。操作人員必須經過專門培訓,嚴格遵守操作規程。建議操作人員佩戴自吸過濾式防塵口罩,戴化學安全防護眼鏡,穿防毒物滲透工作服,戴橡膠手套。避免產生粉塵。避免與酸類接觸。搬運時要輕裝輕卸,防止包裝及容器損壞。配備泄漏應急處理設備。倒空的容器可能殘留有害物。稀釋或製備溶液時,應把鹼加入水中,避免
沸騰和飛濺。
儲存注意事項
儲存於陰涼、通風的庫房。遠離火種、熱源。應與酸類等分開存放,切忌混儲。儲區應備有合適的材料收容泄漏物。
【禁配物】強酸、鋁、氟
運輸注意事項
起運時包裝要完整,裝載應穩妥。運輸過程中要確保容器不泄漏、不倒塌、不墜落、不損壞。嚴禁與酸類、食用化學品等混裝混運。運輸途中應防曝曬、雨淋,防高溫。車輛運輸完畢應進行徹底清掃。
教育要點
國中階段
國中一般要求掌握有關碳酸鈉的俗稱(純鹼、
蘇打),主要用途,化學式以及一些常用反應
如:
要特別注意碳酸鈉雖然俗名純鹼但其實是一種鹽。
高中階段
高中則要求掌握與NaHCO
3在性質(溶解性、
熱穩定性、鹼性強弱、與酸的
反應速率等)用途等方面的區別以及兩者的鑑定方法等。
其中以Na
2CO
3為代表的強鹼弱酸鹽的
電離和
水解的概念理解、電離和水解平衡的計算尤為重要。



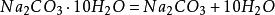
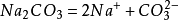
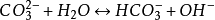
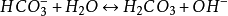
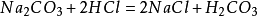
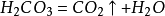

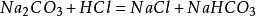


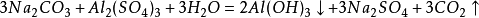
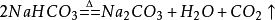

 大蘇打(硫代硫酸鈉)
大蘇打(硫代硫酸鈉)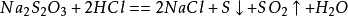

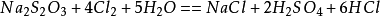
 硫化鈉
硫化鈉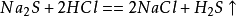

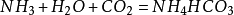
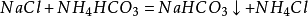
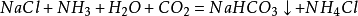
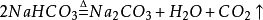
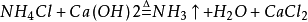
 侯氏制鹼法生產流程
侯氏制鹼法生產流程
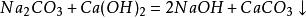
 小蘇打(碳酸氫鈉)
小蘇打(碳酸氫鈉)