硼烷簡介
化學中,硼烷類化合物是指僅由硼元素和氫元素組成的硼氫化合物。它可以用化學通式B
xH
y表示。這類化合物都是通過人工合成得到的。由於硼元素位於化學元素周期表第Ⅲ主族,具有較強的還原性(容易被氧化),因此硼烷類化合物大多遇氧氣和水不穩定,需要在無水無氧條件下(
惰性氣體保護)保存。(甲)硼烷BH
3為氣體,二聚體為乙硼烷B
2H
6。多聚體能形成較大分子量的硼烷,部分大分子量的硼烷由於空間排列不同還存在同分異構體。
化學中最重要的硼烷是乙硼烷B2H6,戊硼烷B5H9和癸硼烷B10H14。
伴隨有機硼化學的發展,不斷有新的理論概念和實驗技術產生。目前硼氫化物作為潛在高能燃料,已經用於火箭彈和汽車燃料。 硼氫化物化學的範圍已擴大至不僅含硼原子還可能還有碳、金屬原子等其他原子。如在碳硼烷、金屬硼烷中一個或多個硼原子被碳原子或金屬原子取代。
硼烷毒性
硼烷的毒性很大:吸入乙硼烷會損害肺部;吸入癸硼烷會引起心力減退;水解較慢的硼烷易積聚而使中樞神經系統中毒,並會損害肝臟和腎臟。
分子通式
已經合成的中性硼烷化合物可以用以下四種通式表示,其中n表示硼原子個數:
| 分子式 | 種類(大括弧中的不能穩定存在) |
通式 | BnHn+4 | B2H6,{B3H7},{B4H8},B5H9,B6H10,B8H12,{B9H13},B10H14,B11H15,B12H16,B14H18,B16H20,B18H22 |
BnHn+6 | {B3H9},B4H10,B5H11,B6H12,B7H13,B8H14,B9H15,B10H16,B13H19,B14H20,B20H26 |
BnHn+8 | B6H14,B8H16,B9H17,B10H18,B14H22,B15H23,B30H38 |
BnHn+10 | B8H18,B26H36,B40H50 |
硼烷及硼烷陰離子主要有以下5種結構:
前綴 | 含義 | 實例 |
closo- | 閉式 | BnHn2-(n=6-12) |
nido- | 巢式 | B2H6,B5H9,B8H12,B10H14,B11H15 |
arachno- | 蛛網式 | B4H10,B5H11,B6H12,B8H14 |
hypho- | 敞網式 | B8H16 |
conjuncto- | 聯式 | B6H14,B7H13,B8H18,B9H17,B10H16,B10H18,B12H104-,B12H102-,B13H19,B14H18,B14H22,B15H23,B16H20,B18H22,B20H16,B20H184-,B20H182-,B20H193-,B20H26,B22H222-,B22H242-,B24H224-,B24H233-,B30H38,B40H50,B48H455- |
命名規則
中性硼烷分子命名
中性硼烷分子命名,硼原子數小於10者用甲、乙、丙、丁、戊、己、庚、辛、壬、癸表示,超過10者用中文數字表示,在硼烷名稱後面還應加上帶圓括弧的
阿拉伯數字,表示硼烷中的
氫原子數。
B
5H
9 戊硼烷(9) pentaborane(9)
B6H12 己硼烷(12) hexaborane(12)
硼烷陰離子命名
帶負電性的硼烷陰離子命名,先用數字表示氫原子個數,再按中文表示方法表示硼原子數量,在硼烷名稱後面還應加上帶圓括弧的阿拉伯數字,表示離子所帶電荷數數。
B5H8 八氫戊硼烷(1-) ctahydropentaborate(1−)
不同類型結構命名
不同類型硼烷分子命名在上述基礎上可以加上該類型的前綴,例如:
B5H9 nido−戊硼烷(9) nido−pentaborane(9)
B4H10rachno-丁硼烷(10)rachno−tetraborane(10)
B6H6 六氫−closo−己硼烷(2-) hexahydro−closo−hexaborate(2−)
上述命名相對比較複雜,一般常用的硼烷化合物都有相應的俗名。
原子聚集類型
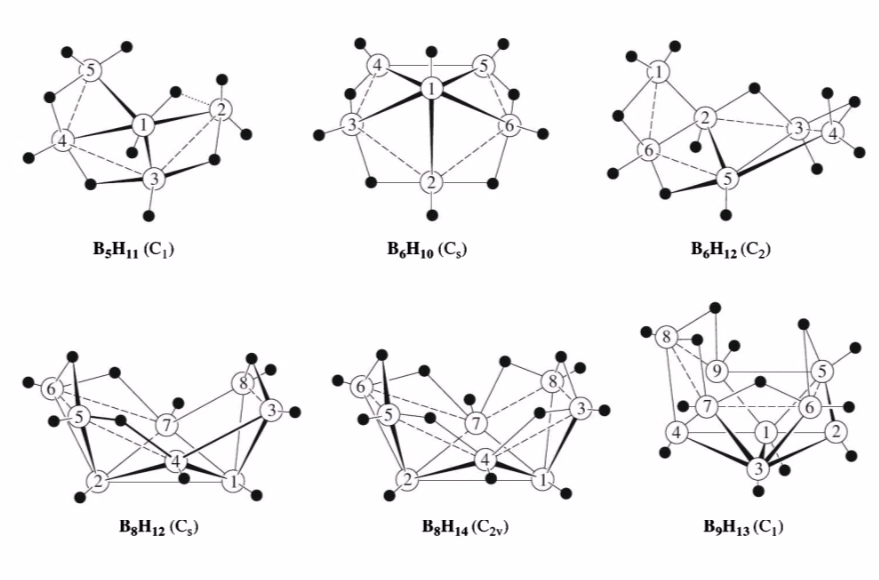
不同數目的硼原子和氫原子聚集形成不同類型的
原子簇,原子的空間排布方式也不同,具體見下圖:
 不同原子聚集類型的空間結構球棍模型
不同原子聚集類型的空間結構球棍模型理化性質
最簡單的硼烷應該是BH
3 ,但這一化合物不能單獨穩定存在,只存在其衍生物,因此,硼烷中的第一個穩定成員是B
2H
6。
乙硼烷易溶於乙醚,其餘多數溶於苯。乙硼烷加熱時易分解成更高級的硼烷和氫氣,多數硼烷在空氣中能自燃,硼烷燃燒時放出大量的熱,所以可用作火箭的高能燃料,但這類物質毒性大,在
一般條件下燃燒不完全。 簡單的硼烷無色,有難聞臭味,性質不穩定,有毒。硼烷分子中組成某些
化學鍵的一對電子共享於3個原子之間,形成了
三中心鍵(BBB鍵和BHB鍵)。可用
鹵化硼與
氫化鋁鋰的反應製取,主要用作噴氣飛機和火箭的高能燃料。
硼元素位於化學元素周期表第Ⅲ主族,原子最外層有三個電子,能與氫原子(或硼原子)形成三個共價鍵,具有較強的還原性,常用作還原試劑。形成三個共價鍵的甲硼烷原子最外層含為6個電子,並非八隅體結構,還有一個空軌道來接受孤對電子,故比較容易與氮原子、氧原子、硫原子等含孤對電子對的原子形成配位鍵。市售的硼烷試劑如硼烷二甲硫醚、硼烷四氫呋喃、N,N-二乙基苯基硼烷等均是甲硼烷與其他物質形成配位鍵的形式保存。
硼烷的毒性很大:吸入乙硼烷會損害肺部;吸入癸硼烷會引起心力減退;水解較慢的硼烷易積聚而使中樞神經系統中毒,並會損害肝臟和腎臟。
乙硼烷燃燒:
B2H6+3O2=B2O3+3H2O
硼烷水解時放出大量的熱,如:
B2H6+6H2O=2B(OH)3↓+6H2
從上述的反應我們知道,硼烷類化合物遇水、遇氧氣極不穩定,容易失效,因此在硼烷化合物的儲存和運輸過程要在無水無氧條件下進行。
硼烷作用
乙硼烷有強還原性,可作還原劑。它跟
氫化鋰反應生成更強的還原劑
硼氫化鋰,用於有機合成。
乙硼烷可用硼的
鹵化物在
乙醚溶液中跟
氫化鋁鋰LiAlH4反應製得。將乙硼烷加熱到100~250℃得其它高硼烷。
最早製取硼烷的方法是用金屬硼化物水解,因產率甚低,已不採用。工業上生產乙硼烷主要是利用三氟化硼與氫化鋰在乙醚中作用製得:
6LiH+2BF3→6LiF+B2H6
硼烷在近代工業和軍事上具有重要用途,由於它燃燒時能放出大量的熱,主要用於火箭和飛彈的高能燃料。此外,還可作為金屬或陶瓷零件的處理劑,也可作為橡膠的交聯劑,在矽橡膠生產中特別有效。
硼烷絡合物
一般胺類分子中的三價氮原子的給電子能力都較二價氧、硫原子強,因而與缺電子的硼烷形成的絡合物相對來說比較穩定,這就賦予這些試劑一些特殊的用途。如二甲胺硼烷和嗎啉硼烷可以在中性或鹼性條件下用於化學鍍(可用於鍍銅、鎳、鉻、金、銀、鈀、鉑、銠、銥等稀貴金屬)的還原劑,國外已大量使用和成百噸的生產。國內也已廣泛開展用硼試劑來進行化學鍍的工作。套用硼烷絡合物的優點是鍍價表面光潔度好,硬度突出,且鍍液可無限循環使用,無污染問題發生。同時它還是可以用作還原其它一些物質的還原劑。國內目前也成數十噸的設備生產。
目前已被用於藥物中間體合成的一個胺類硼烷絡合物是N,N-二乙基苯胺硼烷絡合物。它在製備一些藥物中間體時體現了很好的化學選擇性和光學異構選擇性。河南萬象化工提供N,N-二乙基苯胺硼烷絡合物其生產供應。
此外,作為手性硼試劑來說,α-蒎烯硼烷(IpC2BH)及氯代二(3-蒎基)硼烷(IpC2BCl)已經在多種新藥的合成中得以套用,這些化合物的需求日益劇增。
硼烷作為比較好的在有機化學合成中用到的手性定位選擇還原劑,硼的有機類產品對於合成的選擇還原也是不相同的。如硼烷四氫呋喃絡合物,硼烷二甲硫醚絡合物、硼烷吡啶絡合物、兒茶酚硼烷、頻哪醉硼烷、2-甲基吡啶硼烷、N、N-二乙基苯胺硼烷、三乙基硼,二乙基(3-吡啶)基硼烷等,在新藥的合成手性定位還原方面,用作很重要的用途。
新藥的合成手性定位還原用到最多的催化劑為(R)-2-甲基-CBS-惡唑硼烷、(S)-2-甲基-CBS-惡唑硼烷、二異松蒎基氯硼烷。他們通過把藥物分子中的醛基、酮基直接還原為具有特定手性的醇類,因此套用十分廣泛,尤其是在國內外一些高附加值的藥品的生產過程中。
相關文獻
硼烷方程是日本化學家新村洋一在無機化學概論這本書中提到的。現摘錄如下:
若硼烷化學式為BpHp+q,且x是通常的2中心鍵個數減去p的差,s是橋式H個數,t是3個B形成的3中心鍵個數,y是2中心B-B鍵,則:
s+x=q
s+t=p
t+y=p-q/2
硼烷離子[BpHp+q+c]c+也能列出一個方程:
s+x=q+c
s+t=p
t+y=p-(q/2)-c
不包括BH4-
 不同原子聚集類型的空間結構球棍模型
不同原子聚集類型的空間結構球棍模型