甲磺酸艾日布林注射液是一種抗腫瘤藥物,規格是注射液1mg/2mL。
基本介紹
- 中文名:甲磺酸艾日布林注射液
- 外文名:eribulin mesylate
- 商品名:halavan
- 規格:注射液1mg/2mL
簡介,商品名,英文名稱,結構式,製劑規格,類別,化學名,註冊號,適應症,用法用量,品種特點,國內註冊,特性,臨床試驗,I期,II期,III期,安全耐受,
簡介
商品名
halavan
英文名稱
eribulin mesylate
結構式
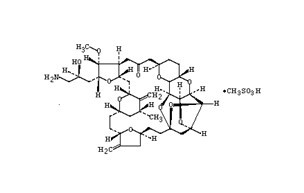 結構式
結構式製劑規格
注射液1mg/2mL
類別
抗腫瘤
化學名
2-(3-amino-2-hydroxypropyl)hexacosa-hydro-3-methoxy-26-methyl-
20,27-bis(methylene)-11,15-18,21-24,28-triepoxy-7,9-ethano-12,15-methano-9H,15H-furo[3,2-i]furo[2',3'-5,6]pyrano[4,3-b][1,4]dioxacy-clopentacosin-5(4H)-one,methanesulfonate(salt);
註冊號
441045-17-6 ,253128-41-5(游離鹼)
適應症
用於治療已經接受過至少2種化療方案治療的轉移性乳腺癌患者,且化療方案中應包括蒽環黴素或紫杉烷。
用法用量
甲磺酸艾日布林以0.5g/mL的濃度溶解於體積分數5%的乙醇水溶液中,一般給藥劑量為(以21 d為一個療程):第1 d和第8 d給予1.4 mg/m2,靜脈注射歷時2-5 min.
品種特點
甲磺酸艾日布林注射液由日本衛材(Eisa)開發,是第1個用於轉移性乳腺癌患者獲得總生存期改善的單藥化療藥,甲磺酸艾日布林單獨化療或與其他化療藥物聯用治療各種癌症,包括膀胱癌、前列腺癌、胰腺癌、頭頸癌、非小細胞肺癌等的臨床研究正在進行中,後續的治療轉移性乳腺癌的國際多中心III期臨床研究也在進行中。甲磺酸艾日布林用於治療轉移性乳腺癌作用非常顯著,後期開發的適應症非常廣泛,是一個極具套用價值的藥物。
國內註冊
美國FDA批准其於2010年11月上市,商品名 HALAVEN™,2011年3月在歐洲上市,國內2013年4月已發臨床批件。暫無其他申請。
特性
臨床前藥代動力學研究結果顯示,甲磺酸艾日布林具有快速分布相和較長的消除相,平均消除半衰期約為40 h ,其體內藥物的藥時曲線下面積(AUC)和血藥峰濃度(Cmax )與劑量呈線性比例。該藥的穩態分布容積為43-114 L/m2 ,血漿清除率為1.16-2.42 L·h-1·m-2 ,消除較慢。儘管已經證實甲磺酸艾日布林經CYP3A4代謝,但其不會影響其他經CYP3A4代謝的藥物,如卡馬西平、地西泮、紫杉醇等。
臨床試驗
I期
針對接受過化療的晚期實體瘤(如大腸癌、卵巢癌、子宮癌、腎癌、肝癌、肺癌等)患者共進行了3項I期臨床研究。第1項由Synold等報導的I期臨床研究共入組40例患者,可評價患者38例,甲磺酸艾日布林給藥方法為d 1,d 8,d 15靜脈滴注,28 d為一個化療周期,確定最大耐受劑量(maximum tolerated dose,MTD)為1.4 mg·m。第2項由Tan等報導的I期臨床研究人組21例患者,試驗中甲磺酸艾日布林的給藥劑量遞增為0.25,0.5,1,2,2.8和4 mg·m ,給藥方法為每21 d靜脈輸注1 h,確定的MTD為2.0 mg·m 。第3項是Goel等報導的共入組32例晚期實體瘤患者的I期臨床研究,甲磺酸艾日布林開始劑量為0.25 mg·m,最大劑量為1.4 mg·m,給藥方法為d 1,d 8,d 15靜脈滴注1 h,28 d為一個化療周期,確定的MTD為1.0 mg·m 。日本Minami等報導的I期臨床研究入組15例晚期實體瘤患者,給藥方法為d 1,d 8靜脈注射,21 d為一個化療周期,最終推薦II期臨床研究劑量為1.4 mg·m。治療中最常見的不良反應為中性粒細胞減少症、疲勞、噁心和周圍神經病變等。
II期
2009年Vahdat等。報導了一項II期臨床研究結果。該項研究為開放性、單臂臨床研究,共入組103例既往接受過蒽環類和紫杉類化療的轉移性乳腺癌患者,具體方案為給予甲磺酸艾日布林1.4 mg·m ,2-5 min靜脈注射,d 1,d 8,d 15,28 d為一周期。由於d 15出現中性粒細胞減少症而調整方案為d 1,d 8靜脈注射,2l d為一周期。在可評價療效的87例患者中,部分緩解(partial response,PR)10例(11.5%),穩定(stable disease,SD)37例(42.5%),疾病進展(progressive disease,PD)36例(41.4%)。總客觀有效率(objective response rate,ORR)為11.5%(95% CI:5.7% -20.1%),臨床獲益率(PR +SD 超過6個月)為17.2%(95% CI:10.0% -26.8%)。中位回響期(median duration of response,MDR)、中位無進展生存期(median progression—free survival,mPFS)和中位總生存期(median overall survival,mOS)分別為171,79和275 d。2010年Cortes等報導一項II期臨床研究結果,該項研究也是開放性、單臂臨床研究,共入組299例既往接受過蒽環類、紫杉類和卡培他濱化療的局部晚期乳腺癌或轉移性乳腺癌患者,其中 291例患者接受甲磺酸艾日布林1.4 mg·m ,2-5 min靜脈注射,d 1,d 8,21 d為一周期。可評價療效的269例患者中,獲PR 25例(9.3%),SD 125例(46.5%),PD 116例(43.1%)。ORR為9.3%(95%CI:6.1% -13.4%),臨床獲益率(PR+SD超過6個月)為17.1%。MDR為4.1個月,mPFS為2.6個月,mOS為10.4個月。
2010年日本Iwata等報導了一項II期臨床研究結果,該項研究也是開放性、單臂臨床研究,80例可評價的局部晚期乳腺癌或轉移性乳腺痛患者接受甲磺酸艾日布林1.4 mg·m,2-5 rain靜脈注射,d l,d 8,21 d為一周期。結果ORR為21.3%(95% CI:12.9% -31.8%),CBR為27.5% (95%CI:18.1% -38.6% )。MDR為1 19 d,mPFS為112 d,mOS為331 d。
III期
Twelves等報導一項圍際多中心平行、對照、III期臨床研究(EMBRACE研究),局部晚期乳腺癌或轉移性乳腺痛患者隨機分入甲磺酸艾日布林治療組和對照組(採用其他單藥化療、內分泌治療和生物治療等),762例患昔按照2:1隨機分為治療組和對照組,治療組(n=508)接受甲磺酸艾日布林1.4 mg·m,2-5 rain靜脈注射,d 1,d 8,21 d為一周期,對照組(n=254)接受常規治療,96%接受化療,4%接受內分泌治療。研究結果表明,甲磺酸艾日布林治療組的總生存期為13.1個月,對照組的總生存期為10.6個月,兩組比較有統計學顯著性差異(P=0.04);甲磺酸艾日布林治療組的中位無進展生存期為3.7個月,對照組的中位無進展生存期為2.2個月,兩組比較無統計學顯著性差異(P=0.14);兩組ORR分別為12%和5%(P=0.002)。本品是第1個用於轉移性乳腺癌患者獲得總生存期改善的單藥化療藥,基於此項研究結果,本品被美國FDA批准用於治療至少接受過2種化療方案(含蒽環類和紫杉類化療藥物)的轉移性乳腺癌患者。另一項人組1102例局部晚期乳腺癌或轉移性乳腺癌患者的III期臨床研究正在進行中,該項研究的主要目的是評價甲磺酸艾13布林和卡培他濱(capecitabine)對照治療對生存質量的改善以及安全性等。
安全耐受
幾項I期臨床研究結果均顯示,中性粒細胞減少症是本品的一種最常見的劑量限制性毒性,發生率從22%(劑量為1.4 mg·m )上升為100%(最大給藥劑量為4 mg·m時) 。Goel等報導的I期臨床研究結果最常見的不良反應為疲勞(53% ),其次為噁心(41%)和厭食(38%)。Tan等報導的I期臨床研究結果最常見的不良反應為中性粒細胞減少症(38%,33%為3-4級),疲勞(33%,均為1-2級)和脫髮(33%,均為1-2級)。Vahdat等報導的II期臨床研究結果顯示,甲磺酸艾日布林治療中最常見的3-4級不良反應依次為中性粒細胞減少症(64%),白細胞減少症(18% ),疲勞(5%),周圍神經病變(5%)和發熱性中性粒細胞減少(5%)。Cortes等報導的II期臨床研究結果顯示,本品治療中最常見的3-4級不良反應為中性粒細胞減少症(54%),白細胞減少症(14%),疲勞無力(10%)等。在III期臨床研究(EMBRACE研究)中,除了中性粒細胞減少症為3-4級外,大多數不良反應為1-2級,中性粒細胞減少症發生率3級為21.1%,4級為24.1%。周圍神經病變3級為7.8%,4級為0.4%。
作為具有全新作用機制的微管蛋白聚合抑制劑,甲磺酸艾日布林為局部晚期乳腺癌或轉移性乳腺癌患者提高生存率和生活質量提供了新的治療手段。