基本介紹
- 中文名:氣體方程式
- 特點:以氣態的性質最為簡單
- 特色:液體則呈無序狀態
- 類型:氣體
定義,推演,
定義
氣體和液體同屬流體,具有流動性。氣體能充滿容納它的容器,而液體的形狀則隨容器變化。低壓下氣體密度小,分子間距離大,相互作用力弱,極限情況下可以把氣體分子當成無大小和無相互作用的質點,以此為基礎擬出的簡單氣體模型可以解釋低壓下氣體的一些基本性質。當壓力增大,氣體密度增加,則上述假設與實際情況偏差較大,必須加以修正。為討論方便起見,常把氣體分為兩種類型:(1)理想氣體和(2)實際氣體。
推演
體系的狀態為其各項物理性質和化學性質的綜合表現。處於一定狀態時,表征體系各項性質的物理量如壓力(p)、溫度(T)、體積(V)、密度(ρ)、折射率(nD)、電導率(к)……之間存在著一定的關係,而表示這類關係的方程式,則稱為"狀態方程式"。
常用易於直接測量的物理量如 p、V、T 和 n(物質的量)以描述氣體的狀態。實驗證實,當氣體組成不變時(即 n 為恆量),一定狀態下,p、V、T 三個變數中只有二個是獨立的,也就是當壓力和溫度確定之後,體系的體積也隨著確定了下來:
V=f(p,T)
對於數量可以變動的純氣體體系,描述體系性質時則需多引入另一變數-氣體物質的量 n,即:
V=f(p,T,n)
理想氣體狀態方程式的實驗基礎是三個實驗定律:(1)波義爾(Boyle)定律;(2)查理士一蓋·呂薩克(Charles-Gay-Lussac)定律和(3)阿佛加德羅(Avogadro)定律。
1662年波義爾由實驗得出如下結論:
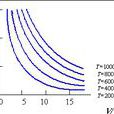
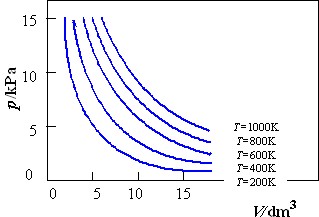
恆溫下一定量氣體的體積與其壓力成反比"。即
v=K1/p
其中 K1 為取決於氣體溫度和數量的常數。
上述結論常稱為"波義爾定律"。
常用易於直接測量的物理量如 p、V、T 和 n(物質的量)以描述氣體的狀態。實驗證實,當氣體組成不變時(即 n 為恆量),一定狀態下,p、V、T 三個變數中只有二個是獨立的,也就是當壓力和溫度確定之後,體系的體積也隨著確定了下來:
V=f(p,T)
對於數量可以變動的純氣體體系,描述體系性質時則需多引入另一變數-氣體物質的量 n,即:
V=f(p,T,n)
理想氣體狀態方程式的實驗基礎是三個實驗定律:(1)波義爾(Boyle)定律;(2)查理士一蓋·呂薩克(Charles-Gay-Lussac)定律和(3)阿佛加德羅(Avogadro)定律。
1662年波義爾由實驗得出如下結論:
恆溫下一定量氣體的體積與其壓力成反比"。即
v=K1/p
其中 K1 為取決於氣體溫度和數量的常數。
上述結論常稱為"波義爾定律"。
1802年蓋· 呂薩克在查理士的實驗基礎上進一步總結出如下規律,稱為"查理士-蓋·呂薩克定律":"恆壓下一定量氣體的體積與其溫度成正比"。
1811年阿佛加德羅作出了如下假設,這一假設後經實驗證實,常稱為"阿佛加德羅定律":
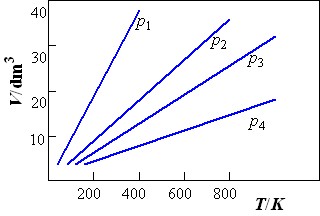
"溫度和壓力恆定時,氣體的體積與其物質的量成正比"。
狀態函式具有單值性,其微分為"全微分"(exactdifferential)。
2.摩爾氣體常量R
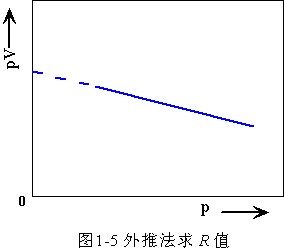
摩爾氣體常量R可根據下式由實驗確定:
壓力趨於零時實驗測量有困難,但可用外推法求得。恆溫下,測量 V 隨 p 變化關係,並作 pV~p 圖,外推至 p→0,由 pV 軸截距可求出值,代入上式即可求出 R 數值。例如,已知 0℃(273.15K)溫度下當氣體的物質的量為 1 摩爾時其值為 2271.1J,代入上式得:
由量綱分析得知 pV 乘積具有能量的量綱:
上式中符號 dimpV 表示物理量的量綱,F 為作用力,A 為作用面積,l 為長度。而 M、L、T 分別為基本物理量-質量、長度和時間-的量綱。因此,R 的量綱為:
式中 N 和 Θ 分別表示物質的量 n 和溫度 T 的量綱。
量綱分析是一種幫助判斷物理量的物理意義和相互關係的有效手段,這種分析方法在後面還要遇到。
在 SI 單位制中能量單位用J(焦耳)表示。此外,能量還常用 dm3。kPa(立方分米·千帕斯卡)、cm3·kPa(立方厘米·千帕斯卡)、cal(卡)和 ergs(爾格)等單位表示。表示方法不同,R 的數值亦異,列表於下:
表1-2 R 的各種不同數值
R 8.31442 0.082057 8.31442 1.98719 8.31442x107
單位 J·K-1·mol-1 dm3·atm·K-1·mol-1 dm3·kPa·K-1·mol-1 cal·K-1·mol-1 erg·K-1·mol-1
計算氣體的體積或壓力時,用 dm3·kPa·K-1·mol-1 或 cm3·kPa·K-1·mol-1 等單位較方便;計算能量函式時,用 J·K-1·mol-1 或 cal·K-1·mol-1 較方便;而計算氣體分子運動速度或表面張力時(當用 C·g·S 單位制表示時)用 erg·K-1·mol-1 較方便。總之,應根據不同場合選擇合適的 R 數值和單位。
3.理想氣體狀態方程式套用舉例-摩爾質量的測定
氣體物質的量等於其質量 m 與摩爾質量 M 之比