基本介紹
- 中文名:氟化銀
- 英文名:Silver(I) fluoride
- 化學式:AgF
- 分子量:126.88
- CAS登錄號:7775-41-9
- EINECS登錄號:231-895-8
- 危險性符號:R34 R23/24/25
- 危險品運輸編號:UN 3260 8/PG 2
基本簡介
 晶體結構
晶體結構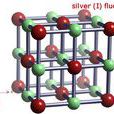
 晶體結構
晶體結構氟化銀,分子式AgF,英文名:Silver(I) fluoride,是銀的氟化物。在常溫下為白色固體或黃棕色固體,熔點435°C,暴露於潮濕空氣時變黑。AgF可由碳酸銀或氧化銀與...
鹵化銀是鹵素與銀形成的化合物,除氟化銀外均為沉澱,氟化銀、氯化銀為白色,溴化銀為淡黃色,碘化銀為黃色。從氟化銀到碘化銀,鹵化銀的溶解度逐漸降低,氯化銀、...
氟化銀(I)是一種化學品,分子式是AgF2。...... 氟化銀(I)是一種化學品,分子式是AgF2。中文名 氟化銀(I) EINECS 232-037-5 分子式 AgF2 分子量 ...
X射線研究表明,Ag2F是由銀、銀和氟的連續層所組成,Ag—Ag的距離為299.6pm和281.4pm,幾乎為Ag原子半徑153pm的兩倍,Ag—F的距離為245.1pm,與氟化銀晶體中...
基本信息CAS登錄號:12249-52-4 中文名稱:氟氫化銀;二氟化銀 英文別名英文別名:Silver(I) hydrogenfluoride; silver hydrogendifluoride; hydrofluoric acid, silver(...
特性及用途 黃綠色固體。密度t3 . 57gIr,礦:在水中分解,在乙醇和氟化銀(}F' :f的飽和溶液.}‘穩定不感光。lUfl0}.'歧化為銀和氟化銀.20f1}、時完個...
用於有機氟化合物(尤其是全氟化合物)的製取,還原產物是二氟化鈷。類似可以用作氟化試劑的金屬氟化物還有三氟化錳、二氟化銀等。 [3] ...
還可將氯化銣溶液加氟化銀軟化成氟化銣及氯化銀。過量的銀鹽通入H2S除去。過濾後在鉑皿中蒸發濾液至近於得到RbF晶體。3、還有一種方法是用銣金屬直接與氟氣反應...
與其他鹵化物不同,金屬鋰、鹼土金屬和鑭系元素的氟化物難溶於水,而氟化銀可溶於水,其他金屬的氟化物易溶於水。氟化氫的水溶液稱氫氟酸,是一種弱酸。金屬氟化...
高價金屬氟化物如三氟化鈷為較元素氟溫和的氟化劑,可從萘和四氫萘的混合物製取全氟萘烷。其他類似的氟化劑為二氟化銀、三氟化錳等。③電化氟化。將有機化合...
以氧化銀、三氧化二鎳、二氟化鎳、氟化銀等為催化劑可使反應度大大提高。 [2] 二氟化氙用途 編輯 主要用作氟化試劑。二氟化氙在反應後,氙一般不會進入到產物...
還可由氯化亞汞與氯化鈉反應製得或將氧化亞汞溶在稀氫氟酸中製得。用作弱氟化劑,其活性與氟化銀相類似,在氟化時要在碘存在下進行。...
該法是將 AgF 與 I2 混合,在適當的條件下使之反應,製取五氟化碘,理論上反應是可行的,但是考慮到氟化銀的原料成本因素,該方法同上一種方法一樣難以成為主要的...
繼諾克斯兄弟之後,魯耶特對氟氣作了長期的研究,最後因中毒太深而獻出了生命,年僅32歲.法國的弗雷迷電解了無水的氟化鈣、氟化鉀和氟化銀,雖然陽極上產生了少量的...
[`}. }L應制得,或由氟乙酸鈉和硫酸混合蒸餾製備還可通過碘乙酸甲脹與氟化銀或氟化亞汞一起加熱得到氟乙酸甲f ltl "再經宅化、酸化製得。鈉鹽可用作殺鼠...
鹵化銀,鹵素與銀形成的化合物,除氟化銀外均為沉澱,氟化銀、氯化銀為白色,溴化銀為淡黃色,碘化銀為黃色。 化學式AgX(X=F-,Cl-,Br-,I-)。 ...
(42)氟鋁化鉀107(43)一氟化氯107(44)二氟化氧108(45)二氟化銀108(46)三氟化氮108(47)三氟化磷109(48)三氟化鈷109(49)三氟化氯110...
1.由碳與氟反應,或一氧化碳與氟反應,或碳化矽與氟反應,或氟石與石油焦在電爐里反應,或二氟二氯甲烷與氟化氫反應,或四氯化碳與氟化銀反應,或四氯化碳與氟化氫...
3 氟化銀 AGF國際公開賽 編輯 AGF填補了中國國內方程式賽事的空白,在中國汽車運動史上具有劃時代意義。賽事全部採用具有“中國芯”(發動機和變速箱具有自主知識產...
