基本介紹
- 中文名:固氮酶
- 外文名:Molybdenum-dependent Nitrogenase
- 解釋:一種能夠將氮分子還原成氨的酶
- 鉬:Mo3+
- 鐵:3個Fe2+,4個Fe3+
- 硫:S2-
- 碳:C4-
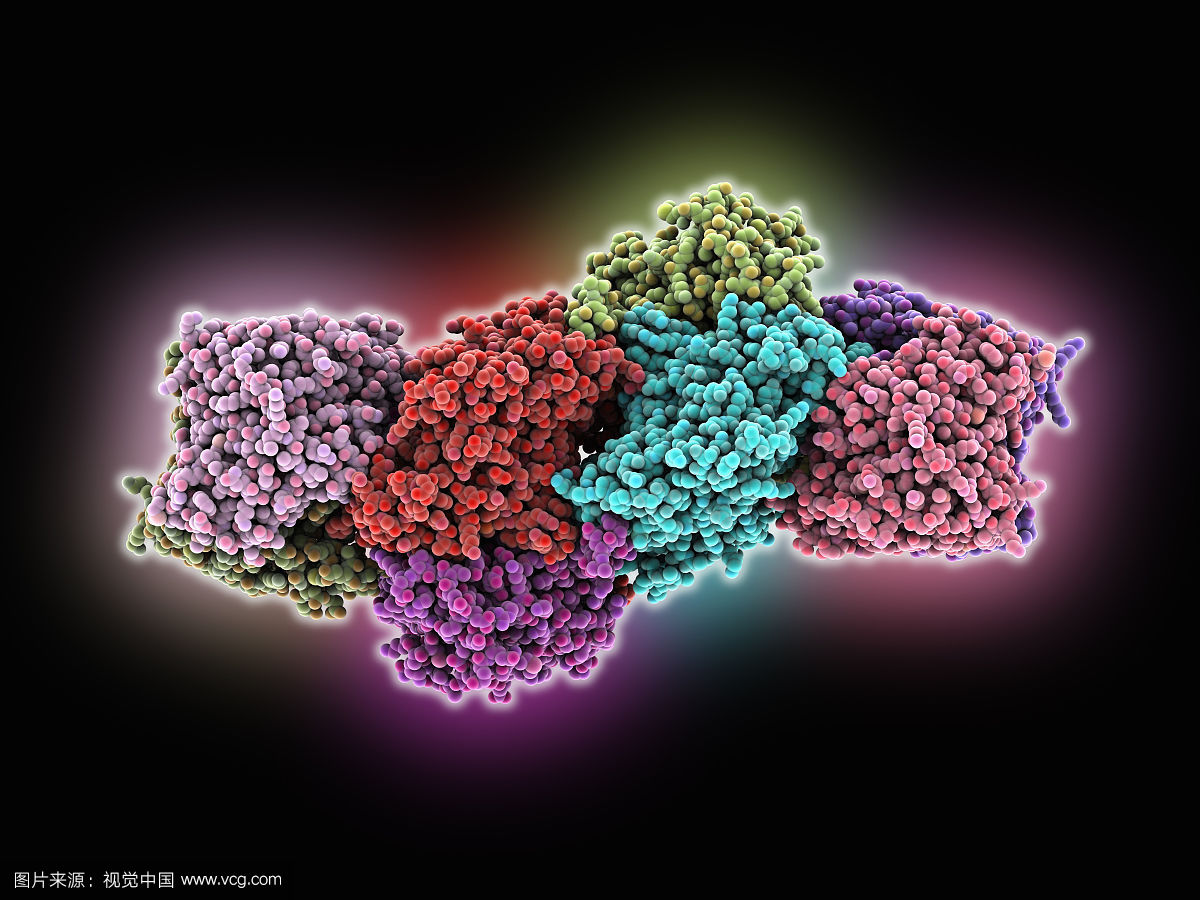
固氮酶是一種能夠將氮分子還原成氨的酶。固氮酶是由兩種蛋白質組成的:一種含有鐵,叫做鐵蛋白,另一種含鐵和鉬mo3+,稱為鉬鐵蛋白。鉬鐵蛋白中含有7個鐵,9個...
生物固氮是指固氮微生物將大氣中的氮氣還原成氨的過程,固氮生物都屬於個體微小的原核生物,所以,固氮生物又叫做固氮微生物。根據固氮微生物的固氮特點以及與植物的...
生物固氮作用,是指大氣中的分子態氮在微生物(固氮生物)體內由固氮酶催化還原為氨的過程。是土壤氮素的重要來源之一。按固氮微生物的特性和它們與其他生物的關係,...
固氮菌屬於細菌的一科。菌體桿狀、卵圓形或球形,無內生芽孢,革蘭氏染色陰性。好氧,厭氧,兼性厭氧均有,有機營養型,能固定空氣中的氮素。包括固氮菌屬、氮單孢...
生物固氮方法指一些微生物,通過體內以固氮酶為中心的固氮反應系統,把空氣中分子態氮轉變成氮化合物的方法。生物固氮的研究範圍很廣,涉及到固氮生物學、固氮生理學...
釩固氮酶,是一種在固氮細菌身上發現的酵素,它是第二種固氮方法,當主要的金屬鉬固氮酵素無法運作時。 在自然的氮循環中,釩固氮酶是非常重要的構成要素,它將空氣...
將空氣中的游離氮轉化為化合態氮的過程,稱為固氮(nitrogen fixation)...... 螺旋桿菌、一些原核低等植物——固氮藍藻、自生固氮菌體內都含有固氮酶,這些酶有固氮...
固氮作用(nitrogen fixation) 是分子態氮被還原成氨和其他含氮化合物的過程。自然界氮(N2)的固定有兩種方式:一種是非生物固氮,即通過閃電、高溫放電等固氮,這樣...
自生固氮菌是指在土壤中能夠獨立進行固氮的細菌。由於培養等處理容易,在實驗室里可固定大量氮素,所以對固氮的研究多使用此種生物。自生固氮菌大多數是桿菌或短...
固氮細菌是一種能進行生物固氮的各種原核生物的通稱,包括自生固氮菌、共生固氮菌、聯合固氮細菌三種;固氮細菌可提高土壤肥力、將一氧化碳變燃料等作用。...
中文名稱 固氮酶活性 英文名稱 nitrogenase activity 定義 固氮酶的作用能力及其強弱。 套用學科 土壤學(一級學科),土壤生物與土壤生物化學(二級學科) 以上內容...
天然固氮是利用自然條件固定空氣中氮氣供使用的氮氣。然固氮遠遠滿足不了農業生產的需求。...
《地球是鐘:固氮篇》是2013年在科學出版社出版的圖書,該書作者是程奇。...... 進化的歷程及其與生物固氮的關係,以及固氮酶與光合作用相關酶的起源和發展關係,引導...
自生固氮微生物是指在土壤中能夠獨立進行固氮的微生物,其中,多數是一類叫做自生固氮菌的細菌。...
氮素是構成生命物質最重要的元素之一。自然界只有某些微生物能直接將大氣中的氮通過固氮酶還原成NH4+,這類微生物包括細菌、藍綠藻、放線菌等。在固氮的細菌中有...
固氮性基因在自然界中一般存在於豆科植物中。能夠將大氣中的氮氣經過一系列的生化反應轉化成固定在根中的化合態的氮。固氮作用是分子態氮被還原成氨和其他含氮化合...
能夠還原分子態氮為氨態氮的微生物。生物固氮作用是自然界中分子態氮轉化為氮素化合物的主要作用。全世界每年由於生物固氮作用所固定的氮素量可達63~175百萬噸,...
一部分氮素由閃電所固定,同時絕大部分的氮素被非共生或共生的固氮細菌所固定。這些細菌擁有可促進氮氣氫化成為氨的固氮酶,生成的氨再被這種細菌通過一系列的轉化以...
自生型固氮微生物是指在土壤中或培養基中生活時,可以自行固定空氣中的分子態氮(氨態氮)的微生物。在進行固氮作用時對植物或其它生物沒有明顯的依存關係。常見的...
藍藻中具有明顯固氮能力的種類。已作過研究或測定過固氮能力的約有160餘種和變種。其中絕大多數屬於段殖體藻目(藻殖段目)Hormogonales中的種類。...
N2和NH4^+培養下糞產鹼菌固氮酶鐵蛋白圓二色譜及熱力學特性比較來源:自然科學 / 生物收藏本文章N2和NH4^+培養下糞產鹼菌固氮酶鐵蛋白的氧化態和還原態的CO譜...
細胞固定胼胝體固定薄膜固定角轉頭固定頰固態發酵固態培養基發酵固有層固有性狀固有感受固有感受器固有的固有的穩定性固有膜固氮固氮作用固氮基因固氮根瘤固氮生物固氮細菌...
性質 分子量59 000~73 000。固氮酶的組分之一。由兩個相同亞基(分子量30 000)組成的二聚體。1mol二聚體中含3~4.1mol鐵,4moL酸不穩定性硫。根瘤菌鐵...
