基本信息
『 作 者:
王后雄主編;蘭東興 本冊主編 』

ISBN: 9787801602077
頁數: 134
定價: 14.0
裝幀: 平裝
出版年: 2003-1-1
簡介
最新修訂
古人云:授人以魚,只供一飯之需;授人以漁,則一生受用無窮。這也是我們編寫這套書的宗旨。作為龍門書局最新推出的《龍門專題》,有以下幾個特點:
1、以“專”為先 本套書總計55種,你盡可以根據自己的需要從中選擇最實用、最可獲益的幾種。
2、講解細緻完備 由於本套書是就某一專題進行集中、全面的剖析,對知識點的講解自然更細緻。
3、省時增效 則於“專題”內容集中,每一本書字數相對較少,學生可以有針對性地選擇,以實現在較短時間裡對某一整塊知識學透、練透的願望。
4、局限性小 與教材“同步”與“不同步”相結合。“同步”是指教材中涉及的知識點本套書都涉及,並分別自成一冊;“不同步”是指本套書不一定完全按教材的章節順序編排,而是把一個知識塊作為一個體系來加以歸納。
5、主次分明 每種書的前面都列出了本部分內容近幾年在高考中所占分數的比例,使學生能夠根據自己的情況,權衡輕重,提高效率。
本套書的另一特點是充分體現“減負”的精神。“減負”的根本目的在於培養新一代有知識又有能力的複合型人才,它是實施素質教育的重要環節。就各科教學而言,只有提高教學質量,提高效率,才能真正達到減輕學生負擔的目的。而本套書中每本書重點突出,進、練到位,對於提高學生對某一專題學習的相對效率,大有裨益。這也是本書刻意追求的重點。
圖書摘要
《龍門專題》這套書習題講解詳細而具體,不僅例題,而且每章後的練習題都有詳細地解答過程,只要認真閱讀和揣摩,就一定能起到舉一反三的效果,這是非常難能可貴的。
《龍門專題》所選的題目固然多,但決無換個數字就算
新題的
濫竽充數之招;題目雖然要求較高,但坡度合理,決非書後題和奧賽題的簡單結合。
《龍門專題》很推崇其中的“知識點精析與套用”、“綜合套用篇”。“知識點精析與套用”將基礎知識脈絡理清,可檢驗我們對基礎知識點的掌握是否牢固紮實。“綜合套用篇”則可幫助我們打開綜合題和應和題的解答思路,面對紛繁多樣的試題,發掘一些固定的方法,
以不變應萬變,從中受益匪淺。
本套書依據教材而不是簡單地重複教材,將數學、物理、化學等學科的知識分成多知識點、知識塊,分為很多冊,分別加以總結和歸納,非常適用於平時有針對性在查漏補缺和系統強化複習。非常人性化,適合不同的學生根據自身情況有針對性地進行輔導學習。題目設計難度適宜,由淺入深。
一本好書可以改變一個人的命運!我們真誠的希望每一個學生都能學會學習,夢想成真。
《龍門專題》,走向清華北大的階梯!...
龍門專題
目錄:
基礎知識與基本力篇
專題考點知識歸納體系框架圖表
1.1 化學反應速率概念及計算
1.2 影響化學反應速率因素
1.3 反應速率圖象分析
高考熱點題型評析與探究
本講高考標準水平測試題
第二講 化學平衡
2.1 化學平衡概念及建立
2.2 等效平衡
2.3 影響化學平衡條件
2.4 化學平衡中圖象問題
高考熱點題型評析與探究
本講高考標準水平測試題
第三講 化學平衡的套用
3.1 合成氨條件的選擇
3.2 其他平衡體系中的套用
高考熱點題型評析與探究
本講高考標準水平測試題
第四講 化學平衡的計算
高考熱點題型評析與探究
本講高考標準水平測試題
3 X題型探究篇
5年高考題型歸類剖析
高考經典試題集訓
考試答題技巧篇
專題知識與力測控試題
《龍門專題:高中化學·化學反應速率與化學平衡》專家推薦:
《龍門專題:高中化學·化學反應速率與化學平衡》摘要精選:
《龍門專題:高中化學·化學反應速率與化學平衡》精選插圖
相關圖書
化學計算(高中化學)/龍門專題
題源(高中化學):化學反應速率與化學平衡
龍門專題:高中化學(化學反應與能量變化)
龍門專題:國中化學·化學實驗與探究
龍門專題--國中化學實驗動畫演示(國中化學)(含盤)
化學計算與化學實驗·國中化學——專題全解
國中化學(化學實驗.化學計算)/專題突破叢書
高中化學(化學實驗化學計算)/專題突破
化學反應速率與化學平衡(高中版)/魔法化學專題突破
05秋龍門專題 化學基本概念和原理 國中化學
國中數學方程(1最新修訂)/龍門專題(龍門專題)
06春龍門新教案 初三化學.下:附中考化學專題
高中化學(化學反應速率化學平衡)/專題突破(專題突破)
04龍門專題 化學計算 化學實驗 國中化學
高中化學(化學反應速率與化學平衡)-首席教師-專題小課本
原理
一、化學反應速率的概念及表示方法
例如:化學反應 速率快慢(定性描述)
爆炸反應和燃燒反應 反應速率極快
酸鹼溶液的中和反應 反應速率快
多數有機反應 反應速率慢
石油的形成 反應速率極慢
化學反應的速率有快有慢,像石油和煤的形成需要上百萬年,而燃燒、中和反應等在瞬間就可以完成。
1.化學反應速率的概念及表示方法
化學反應速率是用來衡量化學反應進行快慢程度的。通常是用單位時間內反應物濃度的減少或生成物濃度的增加來表示。
單位:mol/(L·s)或mol·(L·s),mol/(L·min)或mol·(L·min)
反應速率的表達式為:v= △c/△t
v反應物= △c(反應物的濃度變化)/△t
v生成物= △c(生成物的濃度變化)/△t
△t為反應時間
2.化學反應中的反應速率與化學計量數的關係
在反應2NaOH+H2SO4=Na2SO4+2H2O中,反應前後溶液的體積保持1 L不變,反應前NaOH和濃硫酸的物質的量均為2 mol,經過2 s後有0.4mol Na2SO4生成,求用不同反應物和生成物表示的反應速率,並指出其反應速率間的關係有什麼規律。
分析:
2NaOH + H2SO4 === Na2SO4 +2H2O
起始: 2mol 2mol 0
轉化: 0.8mol 0.4mol 0.4mol
濃度變化: 0.8mol/L 0.4mol/L 0.4mol/L
反應速率: 0.4mol/(L·s) 0.2mol/(L·s) 0.2mol/(L·s)
速率之比: v(NaOH)∶v(H2SO4)∶v(Na2SO4)=2∶1∶1
化學計量數之比:NaOH∶H2SO4∶Na2SO4=2∶1∶1
結論:化學反應中各物質的反應速率之比等於化學方程式中各物質的化學計量數之比。因為化學反應中各物質的量改變值之比等於該化學方程式的係數之比,而在反應體系中各物質在同一容器中,在相同時間內發生反應,故各物質的反應速率之比總是等於化學方程式的係數比。即:
mA(g)+nB(g)=pC(g)+qD(g)
v(A)∶v(B) ∶v(C) ∶v(D)=m∶n∶p∶q
②對同一反應,選用不同物質的濃度變化來表示反應速率時,數值可能不同,化學計量
數相同時,反應速率相同,化學計量數不同則反應速率不同,因此必須標明物質名稱。例如,反應2N2O5=4NO2+O2,可以用v(N2O5)、v(NO2)或v(O2)來表示。反應時各反應物和生成物的濃度有一定的比,所以只需要選用任一物質的濃度的變化來表示,因為各種物質表示的反應速率之比等於化學方程式中各物質的計量係數之比,例如:v(NO2)=2v(N2O5)。
③在反應時反應物和生成物的濃度都在不斷變化,反應速率也隨著改變,所以必須指明某一時刻的速率才有意義,這叫瞬時速率,通常所指的反應速率是一段時間內的平均速率,而不是某一時刻的瞬時速率,二者應加以區別。
④對於可逆反應通常所指的反應速率也是某一物質的正反應速率,而該物質的逆反應速率等於單位時間內該反應物濃度的增加或該生成物濃度的減少。
⑤在反應中純固體和純液體的濃度是恆定不變的,反應速率與其表面積大小有關,而與其物質的量多少無關。通常是通過增加該反應物的表面積(如粉碎成小顆粒)、充分攪拌、振盪等來加快反應速率。
二、影響化學反應速率的因素
比較下列物質與氫氣反應的速率
物 質 | F2 | Cl2 | O2 | N2 | |
內 因 | 分子活潑性 | 最活潑 | 很活潑 | 活潑 | 不活潑 |
外 因 | 通常條件下 | 極快 | 緩慢 | 不反應 | 不反應 |
反應需要條件 | 任何條件 | 光照或點燃 | 點燃 | 高溫、高壓、催化劑 | |
【小結】
1.濃度對化學反應速率的影響
實驗2-2:濃度對化學反應速率的影響
實驗目的:探究反應物的濃度對化學反應速率的影響。
實驗原理:CaCO3+2HCl=CaCl2+CO2↑+H2O。
實驗用品:大理石、1mol/L鹽酸、0.1mol/L鹽酸、試管、鑷子、試管夾、酒精燈等。
實驗操作:①將顆粒大小相同的兩份大理石分別裝入試管中,再分別加入10mL 1mol/L鹽酸和10mL 0.1mol/L鹽酸,觀察現象。
②給加入0.1mol/L鹽酸的試管微熱,觀察現象。
實驗現象:兩支試管都產生氣泡,但加入1mol/L鹽酸的試管中有大量氣泡產生,而加入0.1mol/L鹽酸的試管中氣泡產生的卻很慢。微熱後加入0.1mol/L鹽酸的試管里氣泡的產生有所加快。
實驗結論:在化學反應CaCO3+2HCl=CaCl2+CO2↑+H2O中,鹽酸濃度較大,化學反應速率也較大;鹽酸濃度較小,化學反應速率也較小。
【注意】①兩份大理石要體積大小相同,且是同種大理石,否則無可比性。
②鹽酸的濃度不宜過大也不宜過小,且兩份鹽酸有較大的濃度差別,否則無可比性。
碰撞理論:把能夠發生化學反應的碰撞叫做有效碰撞,把能夠發生有效碰撞的分子叫做活化分子。
a.碰撞理論認為:發生化學反應必先有分子碰撞,但不是每次碰撞都能引起反應。例如:在500℃、101kPa的條件下,濃度為10mol/L的HI氣體中,分子間相互碰撞次數高達每秒3.5×10次之多,但在單位時間內有效碰撞次數卻少得很,因此HI分子要分解成H2分子和I2分子,不會瞬時完成。
b.活化分子的碰撞不一定都是有效碰撞,反應物分子間發生有效碰撞,必須同時滿足兩個條件:一是反應物分子必須有足夠的能量,即達到活化分子具有的最低能量;二是反應物分子必須按一定取向互相碰撞,即“碰撞得法”,才能引起舊鍵斷裂,新鍵形成。前者是能量因素,後者是空間因素。
活化分子比普通分子具有更高的能量,在碰撞時有可能克服原子間的相互作用而使舊鍵斷裂。但活化分子碰撞時,也不是每一次都能起反應的,還必須在有合適的取向時的碰撞才能使舊鍵斷裂。
例如,HI分子的分解反應2HI H2+I2可能有以下幾種碰撞,如圖所示。
在Ⅰ中,HI分子沒有足夠的能量,因此碰撞過輕,兩個分子又彼此彈離;在Ⅱ中,由於碰撞沒有合適的取向,因此兩個分子也彼此彈離;在Ⅲ中,分子具有足夠的能量且碰撞的取向合適,成為活化分子的有效碰撞,因此導致H—I鍵的斷裂及H—H鍵和I—I鍵的形成,即HI發生分解反應,生成H2和I2。
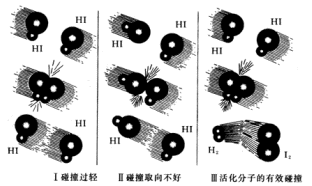
規律:在其他條件不變時,對某一反應來說,活化分子在反應物分子中所占的百分數是一定的,反應物濃度增大→活化分子數增多→有效碰撞增多→反應速率增大。因此,增大反應物的濃度可以增大化學反應速率。
注意:①化學反應速率與濃度有關,而與物質的總量無關。
②對不溶的固態物質或純液體,其濃度是不變的,所以反應速率與接觸表面積有關。在考慮濃度對反應速率的影響時,它們的量的多少對反應速率的影響可以忽略。
[思考題]實驗室制氯氣時,為什麼要用濃鹽酸,而不能用稀鹽酸?
2.壓強對化學反應速率的影響
根據氣態方程pV=nRT,對氣態反應來說,當溫度一定時,一定量氣體的體積與其所受壓強成反比,如果氣體的壓強增大到原來的2倍,氣體的體積就縮小到原來的 ,單位體積內的分子數就增大到原來的2倍,如圖所示。所以,增大壓強,就是增加單位體積里反應物的物質的量,即增大反應物的濃度,因而可以增大化學反應速率。相反,減小壓強,氣體的體積就擴大,濃度減小,因而化學反應速率也減小。
規律:對於氣態反應或有氣體物質參加的反應,增大壓強可以增大化學反應速率;反之,減小壓強則可以減小化學反應速率。
說明
①對於氣態物質來說,壓強對反應速率的影響就是濃度對反應速率的影響。改變壓強,對化學反應速率產生影響的根本原因是引起濃度改變,通常所指改變壓強即是指改變氣體的體積。所以,在討論壓強對反應速率的影響時,應區分引起壓強改變的原因。對於氣體反應體系,有以下幾種情況:
a.恆溫時:增加壓強 體積縮小 濃度增大 反應速率加快
b.恆容時:充入氣體反應物
總壓增大 濃度增大 反應速率加快
充入稀有氣體
總壓增大,但各物質濃度不變,反應速率不變
c.恆壓時:充入稀有氣體 體積增大 各反應物濃度減小 反應速率減慢
②反應物都是固體、液體時,由於改變壓強對它們的體積改變很小,因而對它們的濃度改變很小,可以認為壓強與它們的反應速率無關。
③加壓一定會使氣體反應速率加快,但有的氣體反應在壓強不同時,會生成不同的產物,加壓不一定有利於加快該反應的速率,而可能加快了其他反應的速率。
[思考與討論]為什麼實驗室通常很少用加壓的手段來加快氣體反應速率?
因為加壓的設備和操作比較複雜。工業實際生產中,由於加壓對生產設備要求高,因此,如果不是提高反應程度的需要,一般儘量不採取加壓的方法增大反應速率。通常只有在其他條件均不能達到目的的情況下,才採取加壓措施。
例如,接觸法制硫酸工業中,SO2+O2→SO3反應,在常溫下,SO2的轉化率高於90%,因此不需要加壓,而是通過加熱和加催化劑來增大反應速率。而N2+H2→NH3的反應,在其他條件都採取的情況下,反應物的轉化率也達不到要求,所以加壓是必要的。
3.溫度對化學反應速率的影響
實驗:溫度對化學反應速率的影響
實驗目的:探究溫度對化學反應速率的影響
實驗原理:Na2S2O3+H2SO4=S↓+SO2↑+Na2SO4+H2O
S2O +2H=S↓+ SO2↑+H2O
實驗操作:用三個潔淨的小燒杯,編號為1、2、3在小燒杯的底部貼上寫有黑色“S”字的小紙條,並按下表規定的用量分別加入Na2S2O3溶液和蒸餾水,搖勻,在室溫條件下,向1號燒杯中加入2mL H2SO4溶液,並記錄時間,到溶液出現渾濁現象,使燒杯底部的“S”字看不見時,停止記時,再把另兩個燒杯分別放入盛有熱水、沸水的大燒杯中保持一會兒,然後分別加入2mL H2SO4溶液,並開始記錄時間,到溶液出現渾濁現象,使燒杯底部的“S”字看不見時,停止記時,將記錄的時間分別填入下表。
編號 | 加Na2S2O3溶液的體積/mL | 加H2O的
體積/mL | 加H2SO4的
體積/mL | 溫度/℃ | 出現渾濁
所需時間/s |
1 | 5 | 5 | 2 | 室溫 | |
2 | 5 | 5 | 2 | 熱水浴 | |
3 | 5 | 5 | 2 | 沸水浴 | |
實驗現象:三個燒杯中出現渾濁所需時間的長短關係為:1>2>3。
實驗結論:在其他條件相同時,升高溫度能加快化學反應速率,降低溫度能減慢化學反應速率。
【注意】①熱水浴的水溫在50℃~60℃的範圍內為宜。
②放入熱水和沸水中的燒杯,要保持一會兒後再分別加入2mL H2SO4,目的是使小燒杯內液體的溫度和大燒杯內液體的溫度達到一致。
③三組實驗中要用同濃度的Na2S2O3溶液和H2SO4,且要按照表中所規定的比例取用Na2S2O3溶液、水和H2SO4的體積,並保持總體積相同。
④三個“S”字的清晰度要相同。
⑤對三個燒杯內的混合溶液攪拌的程度、時間要相同。
⑥
計時器(秒表)在使用前要先進行檢驗、校對,保證其靈敏、準確。
⑦對三個燒杯內反應記時的起始點和終止點要相同。
在濃度一定時,升高溫度,反應物分子的能量增加,使一部分原來能量較低的分子變成活化分子,從而增加了反應物分子中活化分子的百分數,使有效碰撞次數增多,因而使化學反應速率增大。當然,由於溫度升高,會使分子的運動加快,這樣單位時間裡反應物分子間的碰撞次數增加,反應也會相應地加快,但這不是反應加快的主要原因,而前者是反應加快的主要原因。
規律:升高溫度可以加快化學反應速率,溫度越高化學反應速率越大;降低溫度可以減慢化學反應速率,溫度越低化學反應速率越小。經過多次實驗測得,溫度每升高10℃,化學反應速率通常增大到原來的2~4倍。
4.催化劑對化學反應速率的影響
實驗:催化劑對化學反應速率的影響
實驗目的:探究催化劑對化學反應速率的影響。
實驗原理:2H2O2 2H2O+O2↑
實驗用品:5% H2O2溶液、洗滌劑、MnO2粉末、試管、藥匙等。
實驗操作:①在兩支試管里分別加5mL質量分數為5%的H2O2溶液和3滴洗滌劑;②向其中一支試管中加少量MnO2粉末,觀察反應現象。
實驗現象:在盛有H2O2的試管中加入MnO2粉末時,立即有大量氣泡產生,而在沒有加入MnO2粉末的試管中只有少量氣泡出現。
實驗結論:在其他條件相同時,加入催化劑能改變化學反應速率。
【注意】
①在MnO2的催化作用下,H2O2的分解反應非常劇烈,故加入試管中的H2O2不宜過多,否則產生的氧氣太多、太急,不易控制。催化劑用量要少,試管不可太小,以防止反應過分劇烈而使反應物衝出試管。
②由於H2O2分解時反應劇烈,如果有有機物雜質存在時,可能會引起爆炸,故所用MnO2應該預先進行灼燒以除去其中的有機物雜質。H2O2溶液不要太濃,以5%為宜,以免發生危險。
催化劑能夠改變化學反應速率的原因,是它能夠降低反應所需要的能量,這樣就會使更多的反應物分子成為活化分子,大大增加單位體積內反應物分子中活化分子所占的百分數,從而成千成萬倍地增大化學反應速率。
規律:對於某些化學反應,使用催化劑可以加快化學反應速率。
由於催化劑能成千成萬倍地增大化學反應速率,因此,催化劑在現代化工業生產中占有極為重要的地位。據初步統計,約有85%的化學反應需要使用催化劑,有很多反應還必須靠使用性能優良的催化劑才能進行。
尋找優良的催化劑是一項意義重大的科學研究,許多科學家為此而奮鬥終身,才創造了今天高度的物質文明。有多位科學家因研究發現了重要的催化劑而榮獲諾貝爾獎。化學之所以成為二十世紀的中心科學,主要歸功於催化化學的高速發展,催化化學仍是今後值得我們們去發展的重點學科。
說明:“改變”的含義是增大或減小。催化劑能增大或減小化學反應的速率。能增大化學反應速率的叫正催化劑,能減小化學反應速率的叫負催化劑。由於負催化劑很少,在中學化學裡並不涉及,所以一般催化劑都是指正催化劑。
【小結】影響化學反應速率的外部條件。
①濃度:其他條件不變時,增加反應物濃度可以增大化學反應速率,濃度越大化學反應速率越大;減小反應物的濃度可以減小化學反應速率,濃度越小化學反應速率越小。原因是物質的濃度的變化使單位體積里活化的分子數發生變化,分子有效碰撞的幾率發生了變化。
②壓強:對於有氣體參加的化學反應,當其他條件一定時,增大壓強,增大化學反應速率,壓強越大化學反應速率越大;減小壓強,減小化學反應速率,壓強越小化學反應速率越小。原因是氣態物質濃度的變化通常隨壓強的變化而變化。
③溫度:升高溫度,可以加快化學反應速率,溫度越高化學反應速率越大;降低溫度可以降低化學反應速率,溫度越低化學反應速率越小。原因是升高溫度使一些普通分子吸收能量變為活化分子;降低溫度使一些活化分子釋放能量變為普通分子。
④催化劑:對於某些化學反應,使用催化劑可以加快化學反應速率。原因是催化劑降低了反應需要的能量,使一些普通分子成為活化分子。
⑤各條件對化學反應速率的影響大小是:催化劑>溫度>濃度=壓強。各種影響都有其局限性,要針對具體反應具體分析。
⑥對化學反應速率的影響除以上四點外,還有光、超音波、雷射、放射線、電磁波、反應物顆粒大小、擴散速率、溶劑等等會對化學反應速率產生影響。
相關視頻
化學反應速率和化學平衡化學反應速率與化學平衡2



