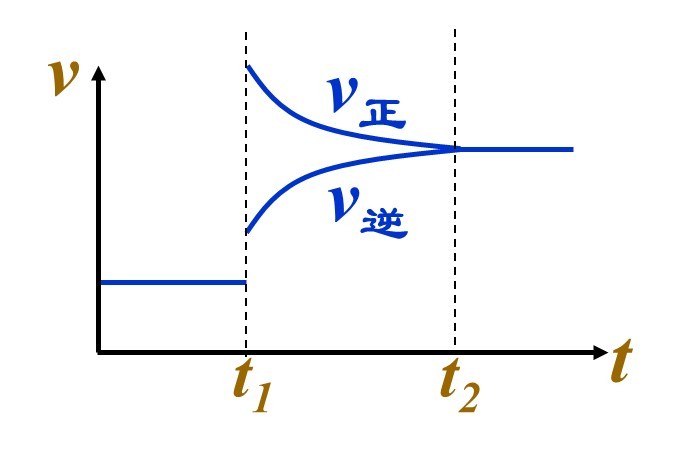
化學平衡是指在巨觀條件一定的可逆反應中,化學反應正逆反應速率相等,反應物和生成物各組分濃度不再改變的狀態。
對於任一可逆的化學反應,在一定條件下達到化學平衡狀態時,體系中各反應物和生成物的物質的量不再發生變化,其活度熵為一定值,並且加催化劑不可改變反應的焓變值
基本介紹
- 中文名:化學反應平衡
- 外文名:Equilibrium
- 學科:化學
- 平衡特徵:逆、等、動、定、變、同
定義
平衡判斷
概念判斷
即:化學平衡的根本標誌是V(正)=V(逆):一定條件下的可逆反應:某物質的消耗速率等於該物質的生成速率;說明該反應達平衡。
因為反應速率之比等於方程式的係數比。所以要描述一個可逆反應達平衡,必須一個描述正反應,一個描述逆反應,且描述的量之比等於方程式的係數比。
條件判斷
(一)有氣體參加或生成的反應
(1)平均摩爾質量M=m(總)/n(總)
① 如果全為氣體:
A:在密閉容器中,如果不是等體積反應:
例:如N2(g)+3H2(g)2NH3(g)其平均摩爾質量M一定,可以說明該反應達平衡。(因為全是氣體,所以氣體的總質量m不變;假設平衡左移,氣體總物質的量增大,假設平衡右移,氣體總物質的量減小,即平衡移動,M一定改變)
B:在密閉容器中,如果是等體積反應:
例如I2(g)+H2(g)2HI(g)其平均摩爾質量M一定,不能說明該反應達平衡。(因為全是氣體,所以氣體的總質量m不變;假設平衡左移,氣體總物質的量不變,假設平衡右移,氣體總物質的量也不變,即平衡移動,M不變)
② 若有固體或液體參加反應或生成:
無論是否是等體積反應,其氣體的平均摩爾質量M一定,一般可以說明該反應達平衡。
特殊情況如反應CO(g)+H2(g==)C(S)+H2O(g)
如果氣體的平均摩爾質量M等於12 g/mol,其平均摩爾質量M一定,不能說明該反應達平衡。(因 為假設平衡左移,氣體總質量每增加12 g,其氣體的物質的量增加1 mol,氣體的平均摩爾質量M不變,假設 平衡右移,氣體總質量每減少12 g,其氣體的物質的量減少1 mol,氣體的平均摩爾質量M也不變)
如果氣體的平均摩爾質量M不等於12 g/mol,其平均摩爾質量M一定,能說明該反應達平衡。(因為假設平衡左移,氣體 總質量每增加12 g,其氣體的物質的量增加1 mol,氣體的平均摩爾質量M一定改變,假設平衡右移,氣體總質量每減少12 g,其氣體的物 質的量減少1 mol,氣體的平均摩爾質量M也一定改變)
(2)混合氣體的平均密度=m(總)/v(總)
①如果全為氣體:
A:在恆容的密閉容器中,
例:如N2 (g)+3H2(g)2NH3(g)其混合氣體的 平均密度一定,不能說明該反應達平衡。
B:在恆壓的密閉容器中:
如果不是等體積反應:
例:如N 2(g)+3H2(g)2NH3(g)其混合氣體的平均 密度一定,能說明該反應達平衡。
如果是等體積反應:
例如I2(g)+H2(g)2HI(g)混合氣體的平均密度一定,不能說明該反應達平衡。
(3)從混合氣體的總壓強考慮(恆溫恆容)
如果不是等體積反應:
例:如N2(g)+3H2(g)2NH3(g)其混合氣體的總壓強p一定,能說明該反應達平衡。
如果是等體積反應:
例如I2(g)+H2(g)2HI(g)混合氣體的總壓強p一定,不能說明該反應達平衡。
(4)若為絕熱體系,溫度一定,可以說明反應達平衡。
(5)合氣體的顏色一定(某氣體有色),可以說明反應達平衡。